
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.04 |
| 2 | 25.00 | 2.00 | 22.00 |
| 3 | 25.00 | 0.20 | 20.21 |
分析 (1)①滴定管中未用标准液润洗,直接加入标准液会稀释溶液浓度减小;
②锥形瓶内水对滴定结果无影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液的颜色变化,以判定滴定终点;
④如溶液颜色发生变化,且半分钟内不褪色为滴定终点;
⑤俯视滴定管读出的消耗标准液体积增大,氢离子物质的量增大,由方程式:4NH4++6HCHO═4H++(CH2)6N4+6H2O判断;
(2)依据滴定前后消耗氢氧化钠溶液的体积的平均值,结合酸、碱反应定量关系计算得到.
解答 解:(1)①滴定管中未用标准液润洗,直接加入标准液会稀释溶液浓度减小,消耗标准液体积增大,氢离子物质的量增大,4NH4++6HCHO═4H++(CH2)6N4+6H2O,反应可知测定氮元素含量偏高,故答案为:偏高;
②锥形瓶内水对滴定结果无影响,故答案为:无影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察锥形瓶中溶液的颜色变化,故选B.
④氢氧化钠滴定酸溶液,达到终点时,酚酞颜色变化为无色变化为红色,半分钟内不褪色,故答案为:无;红;
⑤俯视滴定管读出的消耗标准液体积减小,氢离子物质的量减小,由4NH4++6HCHO═4H++(CH2)6N4+6H2O可知NH4+质量减小,氮的质量分数偏低,
故答案为:偏低;
(2)样品1.5000g,反应为4NH4++6HCHO═4H++(CH2)6N4+6H2O,消耗氢离子的物质的量和氮元素物质的量相同,依据图表数据分析可知,三次实验中消耗氢氧化钠溶液体积分别为:20.02ml、20.00ml、20.01ml,三次均有效,氢氧化钠溶液的平均体积为20.01ml;由酸碱中和反应可知,氢离子物质的量=氢氧化钠物质的量=0.1000mol•L-1×20.01ml×10-3L/ml=2.001×10-3mol;
250ml溶液中氮元素物质的量和氢离子物质的量相同,该样品中氮的质量分数=$\frac{2.001×1{0}^{-3}mol×14g/mol×\frac{250}{25}}{1.5000g}$×100%=18.68%;
故答案为:18.68%.
点评 本题考查了物质性质的实验探究实验设计和分析判断,中和滴定实验的步骤和操作方法,中和滴定计算应用,题目难度中等.


 长江作业本同步练习册系列答案
长江作业本同步练习册系列答案科目:高中化学 来源: 题型:选择题
| A. |  表示1 LpH=2的CH3COOH溶液加水稀释至V L,pH随lgV的变化 | |
| B. | 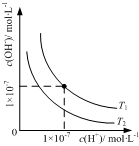 表示不同温度下水溶液中H+和OH-浓度的变化的曲线,图中温度T2<T1 | |
| C. | 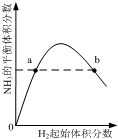 表示一定条件下的合成氨反应中,NH3的平衡体积分数随H2起始体积分数(N2的起始量恒定)的变化,图中a点N2的转化率小于b点 | |
| D. | 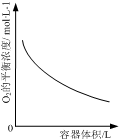 表示同一温度下,在不同容积的容器中进行反应2NO2(g)?2NO(g)+O2(g),O2的平衡浓度与容器容积的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
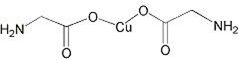 锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:
锂-磷酸氧铜电池正极的活性物质是Cu4O(PO4)2,可通过下列反应制备:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 滴定次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 剩余固体的组成 | m的取值范围 | n的取值范围 |
| 只有铜 | ||
| 有铁和铜 | (用含m的代数式表示) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
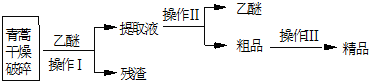
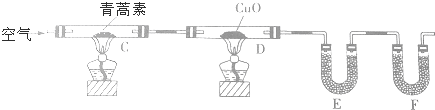
| 装置 | 实验前/g | 实验后/g |
| E | 22.6 | 42.4 |
| F | 80.2 | 146.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
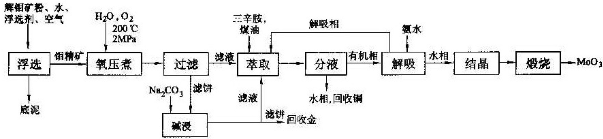
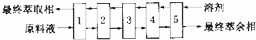
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
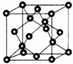 AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.
AIN是重要的半导体材料,Ga(镓)、P、As都是形成化合物半导体材料的重要元素.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com