
【题目】下列各组离子在水溶液中能大量共存的是
A.H+、Fe2+、![]() 、
、![]() B.Na+、OH-、
B.Na+、OH-、![]() 、
、![]()
C.Na+、Al3+、Cl-、![]() D.Fe3+、K+、SCN-、Cl-
D.Fe3+、K+、SCN-、Cl-
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】(1) (CH3CH2)2CHCH3的正确命名是______________,该烃是某炔烃经催化加氢后得到,那么炔烃的结构简式是__________ ,正确命名是____________。
(2)苯酚和浓溴水反应:_________,反应类型____________。
(3)(CH3)2C(OH)CH(OH)CH2OH发生催化氧化反应:_________。
(4)两种饱和一元脂肪醛的混合物,其平均相对分子质量为51。取4.08 g混合物与足量银氨溶液共热,生成银21.6 g。试通过计算判断这两种醛的物质的量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A(g)和2 mol B(g)在2 L的恒容密闭容器中混合并在一定条件下发生反应:2A(g)+B(g) 2C(g) ΔH<0,反应2 s后测得C的浓度为0.6 mol·L-1。下列说法正确的是
A.2 s后物质A的转化率为70%
B.当各物质浓度满足c(A)=2c(B)=c(C)时,该反应达到了平衡状态
C.达到平衡状态时,增加A的物质的量,A和B的转化率都提高
D.达到平衡状态时,升高温度,平衡逆向移动,同时化学平衡常数K减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物F是感冒药的常用成分,一种合成F的路线如下:
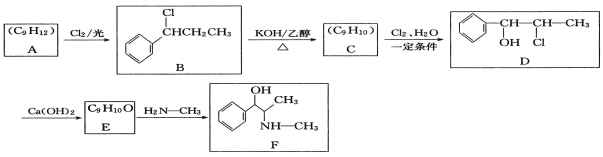
回答下列问题:
(1)A的结构简式为______。
(2)B的化学名称为_________。
(3)由C生成D的化学方程式为____________。
(4)由E生成F的反应类型为___________。
(5)F的分子式为____________。
(6)R是D的同分异构体,则同时符合下列条件的R共有___种。①只含1个甲基②苯环上有2个取代基③能与FeCl3溶液发生显色反应,其中核磁共振氢谱为6组峰,且峰面积之比为1:2:2:3:1:2的结构简式为________、_________。(任写2种)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应且能量变化符合图像的是
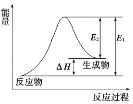
A.C(s)+CO2(g) = 2CO(g)
B.CH4(g)+2O2(g) = CO2(g)+2H2O(l)
C.NaOH(aq)+HCl(aq) = NaCl(aq)+H2O(l)
D.Ba(OH)2·8H2O(s)+2NH4Cl(s) = BaCl2(aq)+2NH3(g)+10H2O(l)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组用如图装置模拟电镀铜和精炼铜。下列说法不正确的是

A.电镀铜和精炼铜时,Y上的电极反应都是:Cu2++2e-=Cu
B.电镀铜时,Y 电极为待镀的金属制品
C.精炼铜时,X 电极是粗铜,比铜活泼的金属最终变成阳极泥
D.电镀铜时,X 电极是铜,溶液中的Cu2+浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图装置来验证同主族元素非金属性的变化规律。
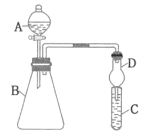
要证明非金属性:Cl>I,在A中加入浓盐酸,B中加入KMnO4(KMnO4与浓盐酸在常温下反应生成氯气),C中加入___溶液,观察到C中___(填实验现象),即可证明。干燥管D的作用是___。从环境保护的角度考虑,此装置尚缺少尾气处理装置,可用___溶液吸收尾气。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用如图所示装置,可以模拟铁的电化学腐蚀,下列说法不正确的是( )

A.若X为碳棒,为减慢铁的腐蚀,开关K应置于N处
B.若X为锌棒,K置于M或N处,均能减慢铁的腐蚀
C.若X为碳棒,将开关K置于M处时铁棒上发生的反应为Fe-2e-=Fe2+
D.若X为锌棒,将开关K置于N处时铁棒上发生的反应为Fe-2e-=Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用 CO2 生产绿色燃料甲醇时发生反应 A:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
(1)2CH3OH(g) + 3O2 (g)=2CO2(g) +4H2O(g) △H= -1365.0kJ/mol
H2(g)+![]() O2 (g) =H2O(g) △H= -241.8 kJ/mol
O2 (g) =H2O(g) △H= -241.8 kJ/mol
CO2(g)+3H2(g)CH3OH(g)+H2O(g)的反应热△H=_________。(写出计算过程)
(2)在体积为 1 L 的恒容密闭容器中发生反应 A,下图是在三种投料[n(CO2)和n(H2)分别为1mol,3mol;1mol,4mol 和 1mol,6mol]下,反应温度对CO2平衡转化率影响的曲线。
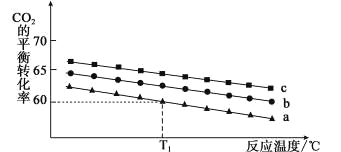
①曲线c对应的投料是_____。
②T1℃时,曲线a对应的化学平衡常数是_____。(写出计算过程,计算结果保留小数点后两位)。
③500℃时,反应A 的平衡常数K=2.5,T1℃_____500℃(填“高于”、“低于”或“等于”)。
(3)甲醇/过氧化氢燃料电池的工作原理示意图如下:
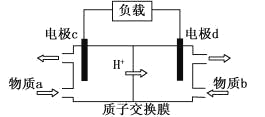
①d电极上发生的是_____(填“氧化”或“还原”)反应。
②物质b是_____(填化学式)。
③写出c电极的电极反应式_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com