
【题目】下列离子在溶液中能大量共存的是( )
A.H+、Fe2+、ClO﹣、Na+
B.Na+、H+、SO42﹣、CO32﹣
C.Fe3+、Cl﹣、Br﹣、SCN﹣
D.Al3+、NO3﹣、H+、NH4+
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】NA为阿伏加德罗常数的值。下列说法正确的是( )
A. 1.4gC2H4、C3H6的混合气体中,所含碳原子总数为0.lNA
B. 在0.1 mol·L Na2S溶液中,S2-、HS-、H2S微粒总数为0.1NA![]()
C. 标准状况下,22.4LC2H6中所含极性共价键的数目为7NA
D. 50mL l2mol·L的浓盐酸与足量MnO2反应,转移电子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W的原子序数依次增大。Z在短周期主族元素中原子半径最大;m、n、p、q为它们的单质;常温下,q为黄绿色气体,a为无色液体;各物质间转化关系如图所示。下列说法不正确的是
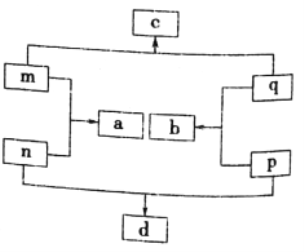
A. d中可能含有非极性共价键
B. Y、Z、W分别与X形成的化合物沸点:Z<Y<W
C. m在q中燃烧,产生大量白雾
D. 元素非金属性:Y>W>X
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒化锌是一种透明黄色半导体,也可作红外光学材料,熔点1520℃.
(1)基态锌原子的价电子排布式是 .
(2)根据元素周期律,电负性SeS,第一电离能SeAs(填“>”或“<”).
(3)H2Se的分子构型是 , 其中Se的杂化轨道类型是 .
(4)H2O的沸点(填“>”或“<”)H2Se的沸点,其原因是: .
(5)晶体Zn为六方最密堆积,其配位数是 .
(6)在硒化锌ZnSe晶胞中,Se2﹣离子作面心立方最密堆积,且Se2﹣与Se2﹣之间的最短距离为a nm,则晶胞边长为 nm.
(7)假设阿伏伽德罗常数值为NA , 则144g 硒化锌ZnSe晶体中的晶胞数是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W是原子序数依饮增大的四种短周期元素,A、B、C、D、F是由其中的两种或三种元素组成的化合物,E是由元素Z形成的单质,0.1mol/LD溶液的pH=13(25℃)。它们满足如图转化关系,则下列说法正确的是

A. 元素Z的最高正价为+6
B. F中含有共价键和离子键
C. 常温下,X、Y、Z、W四种元素组成的盐溶液的pH一定小于7
D. 0.1molB与足量C完全反应共转移电子数为0.2×6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组对采集的酸雨样品进行化验,测得数据如下:c(Na+)=5.0×10-6 mol/L、c(NH4+)=2.0×10-5 mol/L、c(NO3-)=2.0×10-4 mol/L、c(SO42-)=4.0×10-4 mol/L,H+和OH-浓度未测定,则此酸雨的pH约为
A.3 B.4 C.5 D.6
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com