
下列说法正确的是( )
-A.-用量筒量取20.0mL 0.500 0 mol•L﹣1 H2SO4溶液于烧杯中,加80 mL配制成0.100 0 mol•L﹣1 H2SO4溶液
-B.-选用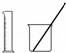 配制100 mL 0.100 0 mol•L﹣1 KMnO4溶液
配制100 mL 0.100 0 mol•L﹣1 KMnO4溶液
-C.-将固体加入容量瓶中溶解并稀释至刻度,配制成一定物质的量浓度的溶液
-D.-用1 g 98%的浓硫酸加4 g水配制成19.6%的硫酸
考点:-配制一定溶质质量分数、物质的量浓度溶液的方法.
分析:-A.20.0mL 0.500 0 mol•L﹣1 H2SO4溶液与80 mL水的体积不等于100ml;
B.容量瓶为配置一定物质的量浓度溶液的专用仪器;
C.依据容量瓶使用注意问题解答;
D.溶液质量由1g变为5g,质量分数变为原先的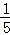 .
.
解答:-解:A.20.0mL 0.500 0 mol•L﹣1 H2SO4溶液与80 mL水的体积不等于100ml,所配溶液的物质的量浓度不准确,故A错误;
B.准确配置一定体积一定物质的量浓度溶液,需要用容量瓶,故B错误;
C.容量瓶为精密仪器,不能用来溶解固体,故C错误;
D.用1g 98%的浓硫酸加4g水,所得溶液中硫酸的质量分数为: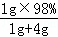 ×100%=19.6%,故D正确;
×100%=19.6%,故D正确;
故选:D.
点评:-本题考查了配制一定质量百分数浓度溶液和一定物质的量浓度溶液,明确配制原理是解题关键,注意容量瓶使用注意的问题.


科目:高中化学 来源: 题型:
在2L容器中发生3A+B═2C的反应,最初加入的A、B都是4mol,10s 内A的反应速率为0.12mol/(L•s),10s后容器内的B的物质的量为()
A. 1.6 mol B. 2.8 mol C. 3.2 mol D. 3.6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
1,6﹣已二酸(G)是合成尼龙的主要原料之一,可用含六个碳原子的有机化合物氧化制备.如图为A通过氧化反应制备G的反应过程(可能的反应中间物质为B、C、D、E和F):
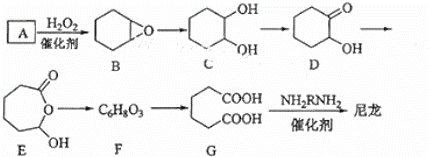
回答下列问题:
(1)化合物A中含碳87.8%,其余为氢,A的化学名称为 .
(2)B到C的反应类型为 .
(3)F的结构简式为 .
(4)在上述中间物质中,核磁共振氢谱出峰最多的是DE,最少的是F.(填化合物代号)
(5)由G合成尼龙的化学方程式为 .
(6)由A通过两步反应制备1,3﹣环已二烯的合成路 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
反应:N2(g)+3H2(g)⇌2NH3(g)△H<0.在等容条件下进行.体系中各物质浓度随时间变化的曲线如图1所示,回答问题:
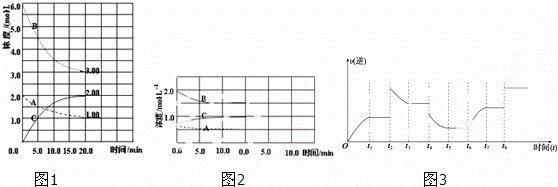
(1)图1中B为 (填“N2”、“H2”或“NH3”)计算反应从开始→达平衡时H2的反应速率v(H2)=
(2)图1是在某温度下反应达到平衡,将容器的体积扩大一倍,假定10min后达到新的平衡,请在图2中用曲线表示体系中各物质的浓度随时间变化的趋势(不需计算新平衡时的具体浓度,只要新平衡时浓度处于一个合理范围内即可.曲线上必须标出N2、H2、NH3).
(3)若该反应的逆反应速率与时间的关系如图3所示:反应在t1、t3、t5、t7时都达到了平衡,而t2、t4、
t6、t8时都改变了条件,试判断改变的条件是(填“升温”、“降压”…等);t2时 ;t6时 ;t4时,平衡向 (填“正”或“逆”)反应方向移动.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图表归纳是学习化学的一种常用科学方法,某同学做出了如图所示的归纳,下列对应正确的是( )
选项-X-Y-Z
A-混合物-溶液-胶体
B-酸-强酸-硫酸
C-纯净物-无机物-甲烷
D-化合物-碱性氧化物-酸性氧化物
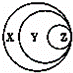
-A.-A-B.-B-C.-C-D.-D
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏加德罗常数,列各项正确的是( )
-A. mol•L﹣1 NaCl溶液含有NA个Na+
-B.-标准状况下,分子数为NA的CO、N2的混合气体体积约为22.4 L,质量为28 g
-C.-标准状况下,22.4 L空气含有NA个单质分子
-D.2.4 L O2所含的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
在碘水中加入四氯化碳,充分振荡后静置,现象是( )
|
| A. | 上层液体呈现紫红色,下层液体几乎无色 |
|
| B. | 液体呈均匀紫红色 |
|
| C. | 下层液体呈现紫红色,上层液体几乎无色 |
|
| D. | 溶液呈无色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com