
| A. | 卤素单质的最外层电子数都是7 | |
| B. | 卤素单质与H2化合的容易程度为F2<Cl2<Br2<I2 | |
| C. | 卤素单质与H2化合的产物由上至下稳定性减弱,其水溶液的酸性增强 | |
| D. | 从F到I,元素非金属性依次减弱,则其最高价氧化物的水化物的酸依次减弱 |
分析 A、同主族元素的原子最外层电子数相同;
B、非金属性越强,则单质与氢气化合越容易;
C、卤族元素从F到I,原子半径在增大,所以同浓度的HX水溶液酸性增强;
D、氟与正价,只有负价和0价.
解答 解:A、同主族元素的原子最外层电子数相同,卤素原子的最外层7个电子,但是卤素单质的最外层电子数都是8,故A错误;
B、非金属性越强,则单质与氢气化合越容易,非金属性:F>Cl>Br>I,则卤素单质与H2化合的容易程度为F2>Cl2>Br2>I2,故B错误;
C、卤族元素从F到I,原子半径在增大,所以同浓度的HX水溶液酸性增强,故C正确;
D、氟与正价,只有负价和0价,故D错误.
故选C.
点评 本题考查了元素周期律,明确同一主族元素周期律的内涵是解本题关键,知道非金属元素非金属性强弱的判断方法,根据元素的非金属性强弱结合元素周期律来分析解答,题目难度不大.


科目:高中化学 来源: 题型:解答题
 A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:
A、B、X、Y、Z是前四周期的常见元素,原子序数依次增大,A可形成自然界硬度最大的单质;B与A同周期,核外有三个未成对电子;X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/mol,I4=11575kJ/mol;常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质;Z的一种同位素的质量数为63,中子数为34,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
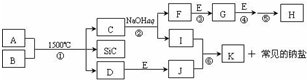 如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.
如图是一些常见元素的单质或化合物之间的转化关系.溶液中的水以及部分反应物或生成物未标出.A、E是空气中的两种主要成分,C是由两种元素组成的新型材料,并且C的原子数、最外层电子数之和与SiC相同,J是一种能引起温室效应的气体,K是两性化合物.反应③、④、⑤用于工业中生产H.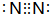 ,G的化学式NO;
,G的化学式NO;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
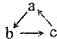 已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )
已知abc是中学常见的含有同种元素的三种物质,具有如图的转化关系(“→”表示在一定条件下可一步完成),下列各组物质中,不符合上述转化关系的是( )| 选项 对应物质 | A | B | C | D |
| a | Cu(OH)2 | Na2O | Fe | Mg |
| b | CuCl2 | NaCl | FeCl3 | MgO |
| c | Cu | Na | FeCl2 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它们的表面都电镀上一层耐腐蚀的黄金 | |
| B. | 环境污染日趋严重,它们表面的铜绿被酸雨溶解洗去 | |
| C. | 铜的金属活动性比氢小,因此不易被氧化 | |
| D. | 它们是含一定比例金、银、锡、锌的铜合金 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 44g N20含有的氮原子数目为NA | |
| B. | 常温常压下,22.4L N2含有的分子数目为NA | |
| C. | lmol Mg变为Mg2+时失去的电子数目为2NA | |
| D. | 1L lmol•L-1K2CO3,溶液中含有的钾离子数目为NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com