
| 化学键 | 键能/(kJ•mol-1) | 化学键 | 键能/(kJ•mol-1) |
| H-H | 436.0 | I-I | 153 |
| O=O | 497.0 | N=N | 946 |
| O-H | 463.0 | H-I | 297 |
| N-H | 391.0 |
| A. | 氢气的燃烧热为△H=-483kJ/mol | |
| B. | H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=-5kJ/mol | |
| C. | N2(g)+3H2(g)?2NH3(g)△H=-92kJ/mol | |
| D. | 在相同条件下,等量的氢气完全燃烧和与氧气组成燃烧电池时,焓变相等 |
分析 A、燃烧热是指1mol纯净物完全燃烧生成稳定的氧化物放出的热量,根据热化学方程式结合△H=反应物的键能之和-生成物的键能之和判断;
B、根据△H=反应物的键能之和-生成物的键能之和判断;
C、根据△H=反应物的键能之和-生成物的键能之和判断;
D、焓变只与反应物的系数以及状态有关.
解答 解:A、由H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=436+497×0.5-2×463=285.5 kJ/mol,可知1mol氢气完全燃烧生成稳定的氧化物放出的热量为285.8KJ,所以氢气的燃烧热△H=-285.5 kJ/mol,故A错误;
B、由H2(g)+I2(g)$\frac{200℃}{\;}$2HI(g)△H=436+153-2×297=-5kJ/mol,故B正确;
C、由N2(g)+3H2(g)?2NH3(g)△H=946+3×436-6×391=-92kJ/mol,故C正确;
D、焓变只与反应物的系数以及状态有关,所以等量的氢气完全燃烧和与氧气组成燃烧电池时,焓变相等,故D正确.
故选A.
点评 本题主要考查了反应热的计算,学生熟记教材知识并灵活应用△H=反应物的键能之和-生成物的键能之和是解题的关键,难度不大.


 字词句段篇系列答案
字词句段篇系列答案科目:高中化学 来源: 题型:解答题
| 乙烷 | 丙烷 | 丁烷 | |
| 熔点(℃) | -183.3 | -189.7 | -138.4 |
| 沸点(℃) | -88.6 | -42.1 | -0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
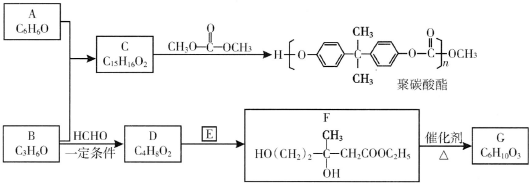
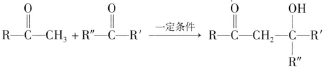 (R、R′、R″为氢原子或烃基)
(R、R′、R″为氢原子或烃基) ,E的分子式是C4H8O2,F生成G的反应类型是取代反应?
,E的分子式是C4H8O2,F生成G的反应类型是取代反应? .G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).
.G的同分异构体有多种,其中和G具有完全相同环状结构的同分异构体有23种(不包含G,不考虑立体异构).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
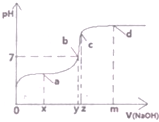 (1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.
(1)25℃时,向20mL0.1mol•L的醋酸溶液中不断滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
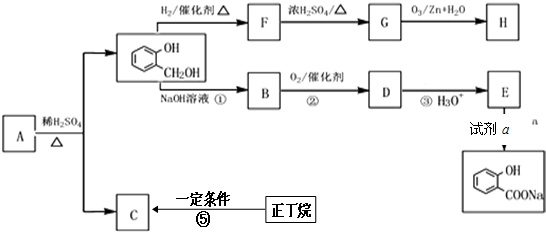
 ,由F到G的反应类型为消去反应.
,由F到G的反应类型为消去反应.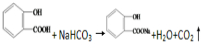 .
.
 的反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:取少量反应后的溶液于试管中,加入氯化铁溶液,若溶液变紫色,则反应不完全,反应物有剩余,反之则完全反应.
的反应是否进行完全,设计一个简单实验加以证明并写出实验操作、现象及结论:取少量反应后的溶液于试管中,加入氯化铁溶液,若溶液变紫色,则反应不完全,反应物有剩余,反之则完全反应.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
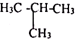 C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.
C、${\;}_{6}^{12}$C和${\;}_{6}^{14}$C D、甲烷和丙烷.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 改进汽车尾气净化技术,减少大气污染物的排放 | |
| B. | 开发利用可再生能源,减少化石燃料的使用 | |
| C. | 过度开采矿物资源,促进地方经济发展 | |
| D. | 研发可降解高分子材料,减少“白色污染” |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com