
分析 在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,2分钟末反应达到平衡状态,生成了0.8mol D,则:
3A(g)+B(g)?2C(g)+2D(g)
起始量(mol):2 2 0 0
变化量(mol):1.2 0.4 0.8 0.8
平衡量(mol):0.8 1.6 0.8 0.8
(1)化学平衡常数是指:一定温度下,可逆反应到达平衡时,生成物的浓度系数次幂之积与反应物的浓度系数次幂之积的比,固体、纯液体不需要在化学平衡常数中写出;
(2)根据c=$\frac{\frac{△n}{V}}{△t}$计算v(D);A的转化率=$\frac{△n(A)}{A的起始物质的量}$×100%;
(3)如果缩小容器容积(温度不变),压强增大,反应气体气体体积不变,平衡不移动,由于混合气体总质量不变,则密度增大;
(4)为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可;
(5)增大反应物的浓度,平衡向正反应方向移动.
解答 解:在一定温度下将2molA和2molB两种气体混合于2L密闭容器中,2分钟末反应达到平衡状态,生成了0.8mol D,则:
3A(g)+B(g)?2C(g)+2D(g)
开始(mol):2 2 0 0
变化(mol):1.2 0.4 0.8 0.8
平衡(mol):0.8 1.6 0.8 0.8
(1)该反应平衡常数表达式K=$\frac{{c}^{2}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$,故答案为:$\frac{{c}^{2}(C)×{c}^{2}(D)}{{c}^{3}(A)×c(B)}$;
(2)v(D)=$\frac{\frac{0.8mol}{2L}}{2s}$=0.2mol/(L•min),A转化率=$\frac{1.2mol}{2mol}$×100%=60%;
故答案为:0.2mol/(L•min);60%;
(3)如果缩小容器容积(温度不变),压强增大,反应气体气体体积不变,平衡不移动,反应混合物都为气体,总质量不变,体积减小,平衡体系中混合气体的密度增大,
故答案为:不;增大;
(4)为等效平衡,应前后气体体积不变,按化学计量数转化到左边,满足n(A):n(B)=1:1即可.
根据3A(g)+B(g)?2C(g)+2D(g),可知C和D各$\frac{4}{3}$mol,转化到左边可得A为2mol,B为$\frac{2}{3}$mol.
令B的物质的量为nmol,则2mol:(n+$\frac{2}{3}$)mol=2mol:2mol,解得n=$\frac{4}{3}$,
故答案为:$\frac{4}{3}$;
(5)增大反应物的浓度,平衡向正反应方向移动,
故答案为:右移.
点评 本题考查反应速率的计算、等效平衡等,难度中等,注意三段式解题法的利用,(4)按化学计量数转化到左边应满足等比不是等量,为易错点,注意理解等效平衡规律.


科目:高中化学 来源: 题型:选择题
| 编码 | 实验 | 现象 |
| A | 加热放在坩埚中的小块钠 | 钠先融化成光亮的小球,燃烧时,火焰为黄色,燃烧后,生成淡黄色固体 |
| B | 在酒精灯上加热铝箔 | 铝箔融化,失去光泽,融化的铝并不滴落,好像一层膜兜着 |
| C | 在空气中久置的铝条放入NaOH溶液中 | 铝条立刻产生大量无色气泡,铝条逐渐变细,铝条逐渐发热 |
| D | 在FeCl2溶液中滴入NaOH溶液 | 生成白色沉淀,沉淀很快变为灰绿色,最后变为红褐色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 用品 |  |  |  |  |
| 主要成分 | Fe | NaHCO3 | Si | Fe2O3 |
| 用途 | 可运输浓硫酸 | 发酵 | 光导纤维 | 涂料 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
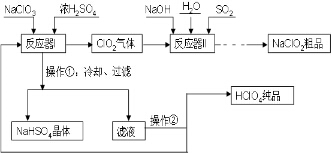 工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:
工业上生产高氯酸(沸点:90°C)时还同时生产了亚氯酸钠,其工艺流程如下:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应时,1 mol Na2O2转移1 mol电子 | |
| B. | 78gNa2O2含有阴、阳离子总数是4NA | |
| C. | 1mo1•L-1的AlC13溶液中,C1-离子的数目为3 NA | |
| D. | 5.6 g铁与足量盐酸反应转移的电子数为0.3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.
甲烷是天然气的主要成分,是生产生活中应用非常广泛的一种化学物质.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 相同条件下,2molA(g)和1molB(g)所具有的总能量小于2mol C(g)所具有的能量 | |
| B. | 增大压强或升高温度,该平衡都向逆反应方向移动 | |
| C. | 将2molA(g)和1molB(g)置于一密闭容器中充分反应后,放出热量为QkJ | |
| D. | 如将一定量A(g)和B(g)置于某密闭容器中充分反应放热Q kJ,则此过程中有2molA(g)被消耗 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) | |
| B. | 点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) | |
| C. | 点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) | |
| D. | 整个过程中可能出现:c(H+)+c(Na+)=c(CH3COOH)+c(CH3COO-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com