
| A、两种气体都被吸收,并有BaSO4沉淀生成 |
| B、只有BaSO4沉淀,SO2通入溶液中无沉淀生成 |
| C、生成BaSO3和BaSO4两种沉淀 |
| D、只生成BaSO3沉淀,SO3从溶液中逸出 |
科目:高中化学 来源: 题型:
| A、苯酚与饱和溴水反应生成三溴苯酚 |
| B、乙酸与乙醇反应制取乙酸乙酯 |
| C、甲烷与氯气反应制取一氯甲烷 |
| D、乙烯与氯化氢反应制取氯乙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、电极只能由两种不同的金属构成 |
| B、负极发生的电极反应是还原反应 |
| C、工作时其正极不断产生电子并经外电路流向负极 |
| D、能将化学能转变为电能 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、0.2 mol/L |
| B、0.5 mol/L |
| C、0.1 mol/L |
| D、0.05 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲基橙呈黄色的溶液中:I-、Cl-、NO3-、Na+ | ||
B、由水电离的c(H+)=1×10-14mol?L-1的溶液中:Ca2+、K+、Cl-、HC
| ||
| C、pH=13的溶液中:K+、Na+、NO3-、ClO- | ||
| D、氯化铝溶液中Na+、AlO2-、NO3-、HCO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氟氯烃是一类含氟和氯原子的卤代烃 |
| B、1-丁烯存在顺反异构 |
| C、1mol甲烷可与2mol Cl2完全取代生成CCl4 |
D、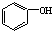 的结构中含有决定醇类性质的官能团--羟基 的结构中含有决定醇类性质的官能团--羟基 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应中生成了22.4L CO |
| B、反应中有12g碳被还原 |
| C、有0.5mol SiO2参加反应 |
| D、反应中有0.5×6.02×1023个电子发生转移 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl溶液、CO2 |
| B、铜、蔗糖 |
| C、液态HCl、NH3 |
| D、汽油、硫酸溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com