
醋酸是日常生活中最常见的调味剂和重要的化工原料,醋酸钠是其常见的盐。
(1)醋酸钠溶液中各离子浓度由大到小的顺序为 。
(2)对于醋酸溶液和醋酸钠溶液的下列说法正确的是 (填字母,下同)。
| A.稀释醋酸溶液,醋酸的电离程度增大,而稀释醋酸钠溶液则醋酸钠的水解程度减小 |
| B.升高温度可以促进醋酸电离,而升高温度会抑制醋酸钠水解 |
| C.醋酸和醋酸钠的混合液中,醋酸抑制醋酸钠的水解、醋酸钠也抑制醋酸的电离 |
| D.醋酸和醋酸钠的混合液中,醋酸促进醋酸钠的水解、醋酸钠也促进醋酸的电离 |
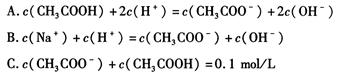
(1)c(Na+)>c(CHCOO-)>c(OH-)>c(H+) (2) C (3) ABC
解析试题分析:盐类的水解程度小,且醋酸钠溶液为碱性,所以离子浓度大小顺序为
c(Na+)>c(CHCOO-)>c(OH-)>c(H+);盐类的水解及弱电解质的电离均为吸热反应,所以升高温度,程度都会增大;稀释溶液程度也会增大;(3)等浓度的两溶液混合由电荷守恒B对、由物料守恒C对、由电荷守恒c(Na+)+c(H+)==c(OH-)+c(CHCOO-)结合各离子浓度可得2c(Na+)==c(CH3COOH)+c(CHCOO-)将两式合并确定A对。
考点:离子浓度大小的比较、盐类水解、弱电解质的电离。


科目:高中化学 来源: 题型:填空题
水溶液中存在多种平衡,请根据所学化学知识回答下列问题:
(1)在浓度均为0.1mol/L①CH3COONH4 ②NH4HSO4 ③NH3.H2O ④(NH4)2SO4溶液中,NH4+浓度由大到小的顺序为 (填序号)
(2)浓度均为0.1 mol·L-1的下列溶液:①硫酸、②醋酸、③氢氧化钠、④氯化铵四种溶液中由水电离出的H+浓度由大到小的顺序是(填序号) 。
(3)恒温下,向pH=6的蒸馏水中加入2.3g金属钠,充分反应后,再加蒸馏水稀释到1L,所得溶液的pH= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
蛇纹石是一种含水的富镁硅酸盐矿物的总称,可以看作由MgO、Fe2O3、Al2O3、SiO2组成。实验室以蛇纹石为原料制取水合碱式碳酸镁,已知:
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀的pH | 1.5 | 3.3 | 9.4 |
| 完全沉淀的pH | 3.7 | 5.2 | 11.0 |
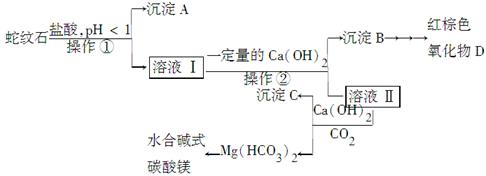
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)有下列物质 ①Cu;②液态SO2;③CH3COOH;④NaHCO3;⑤H2O;⑥熔融NaCl;⑦BaSO4 属于弱电解质的是 (填序号)
(2)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中Na+、HCO3―、CO32―、OH―四种微粒的浓度由大到小的顺序为: 。NaHCO3水解的离子方程式 。
(3)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 | HA物质的量浓度(mol·L-1) | NaOH物质的量浓度(mol·L-1) | 混合溶液 的pH |
| a | 0.1 | 0.1 | pH=9 |
| b | c | 0.2 | pH=7 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
电离平衡常数是衡量弱电解质电离程度强弱的量。已知如表数据。
| 化学式 | 电离平衡常数(25℃) |
| NH3·H2O | Kb=1.77×10-5 |
| HCN | Ka=4.93×10-10 |
| CH3COOH | Ka=1.76×10-5 |
| H2CO3 | Ka1=4.30×10-7,Ka2=5.61×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
醋酸和盐酸是日常生活中极为常见的酸,在一定条件下CH3COOH溶液中存在电离平衡:CH3COOH CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0
(1)常温下,pH=5醋酸溶液中,c(CH3COO-)=______mol/L(精确值,要求列式不必化简);
(2)下列方法中可以使0.10 mol·L-1 CH3COOH的电离程度增大的是
a.加入少量0.10 mol·L-1稀盐酸 b.加热CH3COOH溶液 c.加水稀释至0.010 mol·L-1
d.加入少量冰醋酸 e.加入少量氯化钠固体 f.加入少量0.10 mol·L-1 NaOH溶液
(3)将等质量的锌投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积:V(盐酸)_________V(醋酸)(填“大于”、“小于”或“等于”)
(4)用NaOH溶液分别滴定20.00mL0.1mol/L盐酸和20.00mL0.1mol/L醋酸溶液,得到如图所示两条滴定曲线,用NaOH溶液滴定醋酸溶液的曲线是 (填“图1”或“图2”)
(5)常温下,将0.1 mol/L盐酸和0.1 mol/L醋酸钠溶液混合,所得溶液为中性,则混合溶液中各离子的浓度按由大到小排序为_______________________________。
(6)下图表示溶液中c(H+)和c(OH-)的关系
①M区域内(阴影部分)任意点c(H+)______c(OH-)(填“大于”、“小于”或“等于”)
②在T2温度下,将pH=9 NaOH溶液与pH=4 HCl溶液混合,若所得混合溶液的pH=7,则NaOH溶液与HCl溶液的体积比为 。(混合后溶液体积的变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)25℃时,浓度为0.1 mol·L-1的6种溶液:①HCl, ②CH3OOH, ③Ba(OH)2,④Na 2CO3,⑤KCl,⑥NH4Cl溶液pH由小到大的顺序为__________________(填写编号)。
(2)25℃时,醋酸的电离常数Ka=1.7×10-5mol/L,则该温度下CH3COONa的水解平衡常数Kh= mol ·L-1(保留到小数点后一位)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后,溶液呈 (填“酸性”,“中性”或“碱性”) ,请写出溶液中离子浓度间的一个等式: 。
(4)25℃时,将m mol/L的醋酸和n mol/L的氢氧化钠溶液等体积混合后,溶液的pH=7,
则溶液中c(CH3COO-) + c(CH3COOH)= ,m与n的大小关系是m n(填“ >”“=”或“<”)。
(5)25℃时,将等体积、等物质的量浓度的醋酸与氨水混合后,溶液的pH=7 ,则NH3·H2O的电离常数Ka= 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
硫元素的含氧酸盐在工业上用途广泛,完成下列填空。
工业上用Na2SO3溶液处理工业尾气中的SO2,下表数据表示反应过程中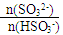 随pH变化的关系:
随pH变化的关系:
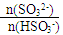 | 91:9 | 1:1 | 9:91 |
| 室温下pH | 8.2 | 7.2 | 6.2 |
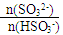 = 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则
= 1时,溶液pH= 7.2的原因:___________________;若用0.20 mol/L 的NaOH溶液(反应前后溶液体积不变)吸收SO2,若反应后溶液呈中性,则查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1) 25℃时,部分弱酸的电离平衡常数如下表:
| 弱酸 | HCOOH | HCN | H2CO3 |
| 电离平衡常数 | Ki=1.7×10-4 | Ki=4.9×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com