
| A. | 第ⅠA族元素的金属性比第ⅡA族元素的金属性强 | |
| B. | 第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强 | |
| C. | 同周期非金属氧化物对应水化物的酸性从左到右依次增强 | |
| D. | 第二周期元素的最高化合价为+1→+7 |
分析 A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强;
B.第ⅥA族元素中,非金属性越强,氢化物越稳定,对应单质的氧化性越强;
C.同周期,从左向右非金属性增强,对应最高价氧化物的水化物酸性增强;
D.第二周期元素O、F没有正价.
解答 解:A.同周期第ⅠA族元素的金属性比第ⅡA族元素的金属性强,若不在同周期,可能第ⅡA族元素的金属性强,如金属性Ca>Na,故A错误;
B.第ⅥA族元素中,非金属性越强,氢化物越稳定,对应单质的氧化性越强,则第ⅥA族元素中,气态氢化物稳定性最好的其单质氧化性也最强,故B正确;
C.同周期,从左向右非金属性增强,对应最高价氧化物的水化物酸性增强,同周期非金属氧化物对应水化物的酸性无规律,故C错误;
D.第二周期元素O、F没有正价,则第二周期元素的最高化合价为+1→+5,故D错误;
故选B.
点评 本题考查位置、结构及性质的应用,为高频考点,把握元素在周期表的位置、元素周期律为解答的关键,侧重分析与应用能力的考查,题目难度不大.


科目:高中化学 来源: 题型:解答题
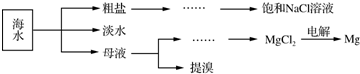
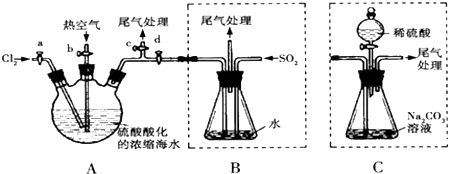
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向水中通入少量的氯气:Cl2+H2O=2H++Cl-+ClO- | |
| B. | Al2(SO4)3中加入过量的氨水:Al3++3NH3•H2O=Al(OH)3↓+3NH4+ | |
| C. | 碳酸氢氨溶液和过量NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| D. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+Cl2↑+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH≡CH+2Br2→CHBr2-CHBr2 | B. | CH3CHO+H2$→_{△}^{催化剂}$CH3CH2OH | ||
| C. |  +HCN$\stackrel{催化剂}{→}$ +HCN$\stackrel{催化剂}{→}$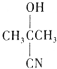 | D. | CH3COOH+NH3$\stackrel{△}{→}$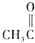 -NH2+H20 -NH2+H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
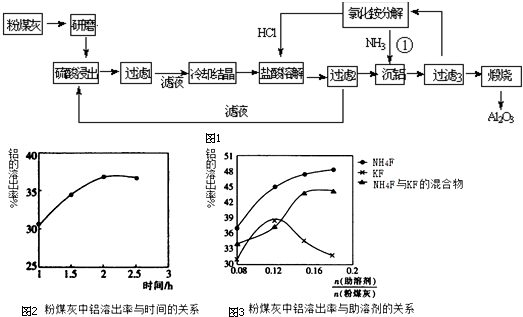
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 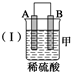 | 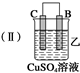 | 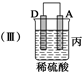 |
| 现象 | 二价金属A 不断溶解 | C的质 量增加 | A上有气 体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com