
| A. | 常温常压下是气体 | B. | 能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 在一定条件下能够聚合生成聚乙烯 |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
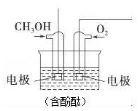 将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:
将甲醇与氧气分别通入如图所示的装置的电极中,可构成甲醇燃料电池,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该电池常温下可稳定工作 | |
| B. | 放电时,电能转变为化学能 | |
| C. | 充电时,阳极发生反应:4OH--4e-═2H2O+O2↑ | |
| D. | 放电时,负极室发生反应:Fe+xH2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$FeOx+xH2,负极发生反应:H2+O2--2e-=H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溴苯中的Br2(氢氧化钠溶液) | B. | 苯中的甲苯(浓溴水) | ||
| C. | 乙烷中的乙烯(酸性高锰酸钾) | D. | 甲烷中的乙炔 (H2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl的稳定性强于H2S | |
| B. | Cl元素最高正价为+7,而S元素最高正价为+6 | |
| C. | 将Cl2通入Na2S溶液中,产生黄色沉淀 | |
| D. | 单质与H2化合所需的反应条件,S比Cl2苛刻 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 升温时水的电离程度会增大,某温度下,pH═7的纯水中OH-浓度可能为10-6mol/L | |
| B. | 室温下,对于0.10 mol/L的醋酸,用NaOH溶液完全中和后,溶液不显中性 | |
| C. | HSO4-既能电离又能水解,且能与强碱溶液反应 | |
| D. | CH3COOH溶液加水稀释后,溶液中c(CH3COOH)/c(OH-)的值增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com