
将1 mol SO2和1 mol O2通入容积固定的密闭容器中,在一定条件下反应达到平衡,平衡时SO3的物质的量为0.3 mol 。此时若移走0.5 mol SO2和0.5 mol O2,则反应达到新平衡时SO3的物质的量( )。
A.为0.3 mol B.为0.15 mol
C.小于0.15 mol D.大于0.15 mol且小于0.3 mol
 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:高中化学 来源: 题型:
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。若As2S3和SnCl2正好完全反应,As2S3和SnCl2的物质的量之比为 。
(2)上述反应中的氧化剂是 ,反应产生的气体可用 吸收。
(3) As2S3和HNO3有如下反应:As2S3+ 10H++ 10NO3—=2H3AsO4+ 3S+10NO2↑+ 2H2O
若生成2mol H3AsO4,则反应中转移电子的物质的量为 。若将该反应设计成一原电池,则NO2应该在 (填“正极”或“负极”)附近逸出。
(4)若反应产物NO2与11.2L O2(标准状况)混合后用水吸收全部转化成浓HNO3,然后与过量的碳反应,所产生的CO2的量 (选填编号)。
a.小于0.5 mol b.等于0.5 mol c.大于0.5mol d.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
以钛酸亚铁(FeTiO3)为原料制取BaTiO3的过程如下图所示:

(1)FeTiO3与稀硫酸反应,产物有TiOSO4、H2O和 (填化学式)。
(2)已知:TiO2(s)+H2SO4(aq)=TiOSO4(aq)+H2O (l) △H=a kJ·mol-1
H2TiO3(s)=TiO2(s)+H2O (l) △H=b kJ·mol-1
写出TiOSO4水解生成H2TiO3的热化学方程式 。
(3)写出TiO2生成BaTiO3的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
氯在饮用水处理中常用作杀菌剂,且HClO的杀菌能力比ClO-强。25 ℃时氯气氯水体系中存在以下平衡关系:
Cl2(g) Cl2(aq) K1=10-1.2
Cl2(aq) K1=10-1.2
Cl2(aq)+H2O HClO+H++Cl- K2=10-3.4
HClO+H++Cl- K2=10-3.4
HClO H++ClO- Ka=?
H++ClO- Ka=?
其中Cl2(aq)、HClO和ClO-分别在三者中占分数(α)随pH变化的关系如图所示 。下列表述正确的是( )

A.Cl2(g)+H2O 2H++ClO-+Cl- K=10-10.9
2H++ClO-+Cl- K=10-10.9
B.在氯处理水体系中,c(HClO)+c(ClO-)=c(H+)-c(OH-)
C.用氯处理饮用水时,pH=7.5时杀菌效果比pH=6.5时差
D.氯处理饮用水时,在夏季的杀菌效果比在冬季好
查看答案和解析>>
科目:高中化学 来源: 题型:
N2O5是一种新型硝化剂,在一定温度下可发生下列反应:
2N2O5(g)  4NO2(g)+O2(g) ΔH>0
4NO2(g)+O2(g) ΔH>0
T1温度下的部分实验数据为:
| t/s | 0 | 500 | 1 000 | 1 500 |
| c(N2O5)/(mol·L-1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法不正确的是( )。
A.500 s内N2O5分解速率为2.96×10-3mol·L-1·s-1
B.T1温度下的平衡常数为K1=125,1 000 s时转化率为50%
C.其他条件不变时,T2温度下反应到1 000 s时测得N2O5(g)浓度为2.98 mol·L-1,则T1<T2
D.T1温度下的平衡常数为K1,T3温度下的平衡常数为K3,若K1>K3,则T1>T3
查看答案和解析>>
科目:高中化学 来源: 题型:
由于温室效应和资源短缺等问题,如何降低大气中的CO2含量并加以开发利用引起了各界的普遍重视。目前工业上有一种方法是用CO2生产燃料甲醇。一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),该反应的能量变化如图所示:
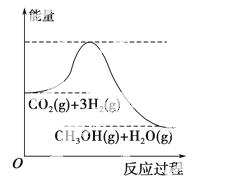
(1)上述反应平衡常数K的表达式为______________________________________________,
温度降低,平衡常数K________(填“增大”、“不变”或“减小”)。
(2)在体积为2 L的密闭容器中,充入1 mol CO2和3 mol H2,测得CO2的物质的量随时间变化如下表所示。从反应开始到5 min末,用氢气浓度变化表示的平均反应速率v(H2 )=________。
)=________。
| t/min | 0 | 2 | 5 | 10 | 15 |
| n(CO2)/mol | 1 | 0.75 | 0.5 | 0.25 | 0.25 |
(3)在相同温度容积不变的条件下,能说明该反应已达平衡状态的是________(填写序号字母)。
a.n(CO2)∶n(H2)∶n(CH3OH)∶n(H2O)=1∶3∶1∶1
b.容器内压强保持不变
c.H2的消耗速率与CH3OH的消耗速率之比为3∶1
d.容器内的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
纳米材料二氧化钛(TiO2)具有很高的化学活性,可做性能优良的催化剂。
(1)工业上二氧化钛的制备是:
I. 将干燥后的金红石(主要成分TiO2,主要杂质SiO2)与碳粉混合装入氯化炉中,在高温下通入Cl2,制得混有SiCl4杂质的TiCl4。
II. 将混有SiCl4杂质的TiCl4分离,得到纯净的TiCl4。
III. 在TiCl4中加水、加热,水解得到沉淀TiO2•xH2O。
IV. TiO2·xH2O高温分解得到TiO2。
①TiCl4与SiCl4在常温下的状态是_______。II中所采取的操作名称_______。
|


②如实验IV中,应将TiO2.xH2O放在_______ (填仪器编号)中加热。
(2)据报道:“生态马路”是在铺设时加入一定量的TiO2,TiO2受太阳光照射后,产生的电
子被空气或水中的氧获得,生成H2O2,其过程大致如下:
a. O2→2O b. O+H2O→2OH(羟基) c. OH+OH→H2O2
①b中破坏的是 (填“极性共价键”或“非极性共价键”)。
②H2O2能清除路面空气中的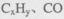 等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
等,其主要是利用了H2O2的 (填“氧化性”或“还原性”)。
(3)过氧化氢是重要的化学试剂,它的水溶液又称为双氧水,常用作消毒、杀菌、漂白等。
某化学兴趣小组取一定量的过氧化氢溶液,准确测定了过氧化氢的含量。
请填写下列空白:
①取10.00 mL密度为P g/mL的过氧化氢溶液稀释至250 mL。取稀释后的过氧化氢溶液25.00mL至锥形瓶中,加入稀硫酸酸化,用蒸馏水稀释,作被测试样。
用高锰酸钾标准溶液滴定被测试样,其反应的离子方程式如下,请将相关物质的化学计量数配平及化学式填写在方框里。
| |
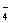 + H2O2+ H+= Mn2++ H2O+
+ H2O2+ H+= Mn2++ H2O+ ②滴定时,将高锰酸钾标准溶液注入______________(填“酸式”或“碱式”)滴定管中。滴定到达终点的现象是____________________________。
③重复滴定三次,平均耗用C mol/L KMnO4标准溶液 V mL,则原过氧化氢溶液中过氧化氢的质量分数为______________。
④若滴定前滴定管尖嘴中有气泡,滴定后气泡消失,则测定结果_________ (填“偏高”或“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO:MgSO4(s)+CO(g)  MgO(s)+CO2(g)+SO2(g) ΔH>0
MgO(s)+CO2(g)+SO2(g) ΔH>0
该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐 标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )。
标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是 ( )。
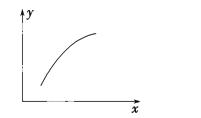
| 选项 | x | y |
| A | 温度 | 容器内混合气体的密度 |
| B | CO的物质的量 | CO2与CO的物质的量之比 |
| C | SO2的浓度 | 平衡常数K |
| D | MgSO4的质量(忽略体积) | CO的转化率 |
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,水的电离达到平衡:H2O H++OH- ΔH>0,下列叙述正确的是 ( )
H++OH- ΔH>0,下列叙述正确的是 ( )
A.向水中加入稀氨水,平衡逆向移动,c(OH-)降低
B.向水中加入少量固体硫酸氢钠,c(H+)增大,KW不变
C.向水中加入少量固体CH3COOH,平衡逆向移动,c(H+)降低
D.将水加热,KW增大,pH不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com