
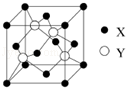
 元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.
元素X 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.元素Y基态原子的3p 轨道上有4个电子.元素Z 的原子最外层电子数是其内层的3倍.分析 元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
解答 解:元素X位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2,核外电子数为2+8+18+2=30,则X为Zn;元素Y基态原子的3p轨道上有4个电子,则Y为S元素;元素Z的原子最外层电子数是其内层的3倍,原子只能有2个电子层,最外层电子数为6,故Z为O元素.
(1)在一个晶胞中,X离子的数目8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,故答案为:4;
(2)H2S分子中S原子杂化轨道数目为2+$\frac{6-1×2}{2}$=4,S原子采取sp3杂化,故答案为:sp3杂化;
(3)水分子与乙醇分子之间形成氢键,H2O在乙醇中的溶解度大于H2S,故答案为:水分子与乙醇分子之间形成氢键;
(4)SO42-中S原子孤电子对数为$\frac{6+2-2×4}{2}$=0,价层电子对数为4+0=4,故其空间结构为正四面体,一种与SO42-互为等电子体的分子的化学式:CCl4或SiCl4,故答案为:正四面体;CCl4或SiCl4.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、晶胞计算、杂化方式与空间构型、等电子体等,注意对基础知识的理解掌握.


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;写出A分子中官能团的名称羧基、羟基;
;写出A分子中官能团的名称羧基、羟基;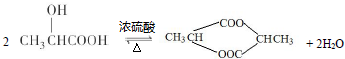 ;
;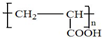 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子氧化性:A(n+1)+>Bn+离子还原性:C(n+1)->Dn- | |
| D. | 单质还原性:A>B,单质氧化性:D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
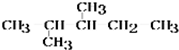
 )在催化剂作用下生成聚苯丙烯的反应方程式:
)在催化剂作用下生成聚苯丙烯的反应方程式:
 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$ +3H2O.
+3H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 弱电解质 | HCOOH | HCN | H2CO3 | NH3•H2O |
| 电离平衡常数 (25℃) | Ka=1.8×10-4 | Ka=4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 | Kb=1.8×10-5 |
| A. | 由上表可知酸性HCOOH>H2CO3 | |
| B. | 0.1mol/L的HCOONH4溶液中:c(HCOO-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | 0.1mol/L的NaHCO3溶液中:c(H2CO3)+c(H+)=c(OH-)+c(CO32-) | |
| D. | 结合H+的能力:CO32->HCO3->CN->HCOO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 名称 | 甲醇 | 二甲胺 | 二甲基甲酰胺 | 甲醚 | 碳酸二甲酯 |
| 结构式 | CH3OH | (CH3)2NH | (CH3)2NCHO | CH3OCH | (CH3O)2CO |
| 沸点(℃) | 64.7 | 7.4 | 153℃ | -24.9 | 90℃ |
| 容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | x | |
| Ⅱ | 387 | 0.40 | y | |
| Ⅲ | 207 | 0.20 | 0.090 | 0.090 |
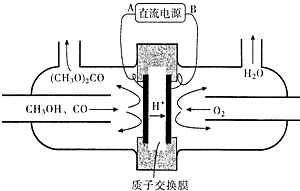
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
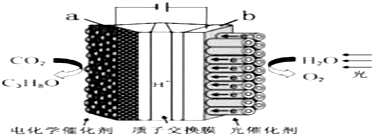
| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从b极区向a极区迁移 | |
| C. | 每生成1 mol O2,有44 g CO2被还原 | |
| D. | a电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com