
分析 原电池总反应式为:Fe+H2SO4=FeSO4+H2↑,计算氢气物质的量,根据方程式计算Fe、硫酸的物质的量,再根据m=nM计算Fe的质量,根据c=$\frac{n}{V}$计算硫酸的物质的量浓度.
解答 解:生成氢气为$\frac{4.48L}{22.4L/mol}$=0.2mol
设消耗Fe、硫酸物质的量分别为x、y,则:
Fe+H2SO4=FeSO4+H2↑
1 1 1
x y 0.2mol
则x=y=$\frac{0.1mol×1}{1}$=0.1mol
故消耗Fe的质量为0.1mol×56g/mol=5.6g
硫酸的物质的量浓度为$\frac{0.1mol}{0.25L}$=0.4mol/L,
答:消耗Fe的质量为5.6g,硫酸的物质的量浓度0.4mol/L.
点评 本题考查原电池的有关计算,比较基础,明确反应的反应即可解答,旨在考查学生对基础知识的巩固.


 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 反应体系的温度改变 | |
| B. | 反应混合物中各组分的百分含量改变 | |
| C. | 正、逆反应速率改变 | |
| D. | 反应物的物质的量改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
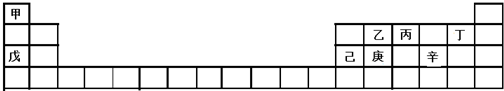
| A. | 甲、戊、己的单质都是金属 | |
| B. | 乙、丙、丁的氢化物稳定性依次增强 | |
| C. | 庚的氧化物不能和丁的氢化物反应 | |
| D. | 己的氧化物能分别与戊和辛的最高价氧化物的水化物反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 元素编号 | 元素性质或原子结构 |
| T | 最外层电子数比内层电子总数少4 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 与氢形成的气态化合物在标准状况下的密度为0.76g•L-1 |
| Z | 元素最高正价与负价的绝对值之差是6 |
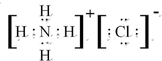 .
.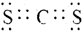 .
. ,
,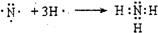 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 10:7:11 | B. | 11:11:8 | C. | 11:10:8 | D. | 10:11:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “青篙一握,以水二升渍,绞取汁”,该过程是对青篙素的提取,属于化学变化 | |
| B. | 向漂白粉溶液中滴加少量醋酸,漂白速率会加快 | |
| C. | 利用生物方法脱除生活污水中的氮和磷,可防止水体富营养化 | |
| D. | 中国古代利用明矾溶液的酸性清除铜镜表面的铜锈 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
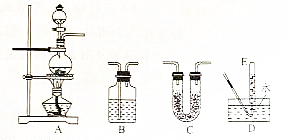
| 选用的仪器 | 加入的试剂 |
| A | 二氧化锰、浓硫酸、食盐 |
| B | 饱和食盐水 |
| B | KBr溶液和CCl4的混合液 |
| D |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | HClO的结构式:H-O-Cl | B. | 纯碱的化学式为:Na2CO3 | ||
| C. | 原子核内有8个中子的碳原子148C | D. | Na2O2电子式为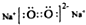 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com