
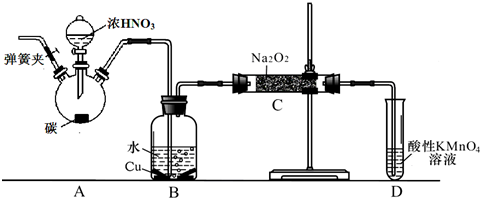
 ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.
ClO2与Cl2的氧化性相近,在自来水消毒和果蔬保鲜等方面应用广泛.某兴趣小组通过图1装置(夹持装置略)对其制备、吸收、释放和应用进行了研究.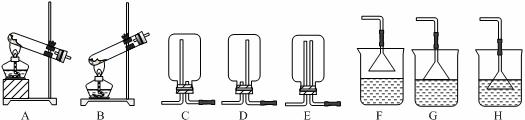
分析 (1)熟悉仪器的形状,说出其名称;F装置应是Cl2和KI反应,导管应长进短出;
(2)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢;
(3)氯气有毒,能够与碘化钾反应,被碘化钾溶液吸收;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成;
(5)实验室用加热固体氯化铵和熟石灰制取氨气(2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,根据氨气为易溶于水密度比空气小的气体性质选择收集装置,氨气极易溶于水,尾气处理需考虑倒吸,据此分析解答;
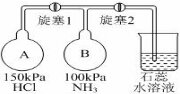
(6))①根据A、B容器压强以及A、B混合后压强相等以及氨气和氯化氢反应生成氯化铵分析;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,氯化铵为强酸弱碱盐,溶液呈酸性,据此分析.
解答 解:(1)依据形状可知图中D为锥形瓶,F装置应是Cl2和KI反应,导管应长进短出,故答案为:锥形瓶; b;
(2)为使ClO2在D中被稳定剂充分吸收,产生ClO2的速率要慢,故答案为:慢;
(3)氯气有毒,能够与碘化钾反应,被碘化钾溶液吸收,所以F的作用为吸收Cl2,故答案为:吸收Cl2;
(4)在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2,根据元素守恒可知应还有水生成,该反应的离子方程式为:4H++5ClO2-=Cl-+4ClO2↑+2H2O; 在ClO2释放实验中,打开E的活塞,D中发生反应,则装置F的作用是验证是否有ClO2 生成,
故答案为:4H++5ClO2-=Cl-+4ClO2↑+2H2O;验证是否有ClO2 生成;
(5)实验室用加热固体氯化铵和熟石灰制取氨气(2NH4Cl+Ca(OH)2?CaCl2+2NH3↑+2H2O),反应发生为固体与固体加热制取气体的装置,因防止药品中的湿存水以及反应产生的水使反应试管受热不均匀,所以选择试管口向下的A装置制备氨气,氨气为易溶于水,不能用排水法收集,密度比空气小,需用向下排空气法收集,所以选择C装置,氨气极易溶于水,尾气处理需考虑倒吸,倒扣的漏斗空间大,水柱不易极速上升,能防止倒吸,故选G装置,
故答案为:ACG;
(6)①A容器压强为150KPa,B容器压强100KPa,A容器压强大于B容器,先打开旋塞1,A容器中的氯化氢进入B容器,氨气和氯化氢反应,NH3+HCl=NH4Cl,生成氯化铵固体小颗粒,所以B瓶中的现象是出现白烟,
故答案为:出现白烟;A瓶压强比B瓶大,氯化氢进入B瓶与氨气反应生成氯化铵固体小颗粒形成白烟;
②氨气、氯化氢为气体反应生成的氯化铵为固体,压强减小,再打开旋塞2,紫色的石蕊试液倒吸入B瓶中,氯化铵为强酸弱碱盐,溶液中铵根离子水解生成一水合氨和氢离子,水解方程式为:NH4++H2O?NH3•H2O+H+,溶液呈酸性,所以紫色石蕊试液变红,
故答案为:烧瓶中的液体倒吸入B瓶,且紫色石蕊试液变红.
点评 本题考查了氯气、氨气的制备以及性质,掌握实验室制取氯气、氨气的原理及性质是解题关键,题目难度中等,侧重考查学生分析能力与实验能力.


科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.43g/L | B. | 1.90g/L | C. | 2.14g/L | D. | 2.38g/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
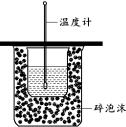 下列实验操作正确的是( )
下列实验操作正确的是( )| A. | 用图装置测定中和热 | |
| B. | 将同浓度的FeCl3溶液和CuSO4溶液分别滴入H2O2中,滴入FeCl3溶液的H2O2更快产生气泡.不能得出结论对H2O2分解的催化效果Fe3+>Cu2+ | |
| C. | 研究H+浓度对该平衡:Cr2O72-+H2?2CrO42-+2H+的影响,往5mL 0.1mol/L K2CrO4溶液加入5mL 0.1mol/L的稀硫酸 | |
| D. | 测定溶液的pH值时,用玻璃棒蘸取少量溶液点在湿润的pH试纸上再与标准比色卡对照 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 胶体的分散质能透过滤纸 | |
| B. | 胶体能产生丁达尔现象 | |
| C. | 胶体粒子直径在10-9~10-7 m之间 | |
| D. | 胶体是纯净物,其它分散系是混合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
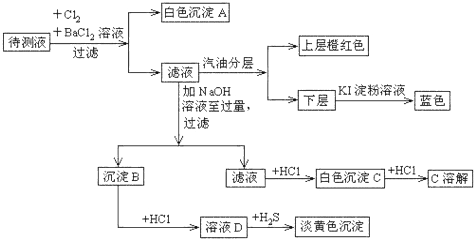
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com