
【题目】一定质量的混合气体在密闭容器中发生如下反应:xA(g)+yB(s)![]() zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
zC(g)。达到平衡后测得A气体的浓度为0.5mol·L-1。当恒温下将密闭容器的容积扩大到原来的二倍,再达平衡后,测得A的浓度为0.2mol·L-1。下列叙述不正确的是( )
A.平衡向正反应方向移动B.z<x+y
C.C的体积分数增大D.A的转化率增大
科目:高中化学 来源: 题型:
【题目】在体积为a L的密闭容器中,放入2LA气体和1LB气体,在一定条件下发生反应:3A(气)+B(气)nC(气)+2D(气),反应达平衡后,A的浓度减少到原来的![]() ,混合气体的平均相对分子质量增大了
,混合气体的平均相对分子质量增大了![]() 倍,则反应式中的n值为
倍,则反应式中的n值为
A.1B.2C.3D.4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值,下列说法中不正确的是
A. 14g由N2和13C2H2组成的混合物中,所含中子数为7NA
B. CH4与白磷(P4)都为正四面体结构,则1mol CH4与lmolP4所含共价键的数目均为4NA
C. 反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
2NH3(g) ΔH=-92.4kJ/mol,若放出热量4.62kJ,则转移电子的数目为0.3NA
D. 常温下,含0.5molNH4NO3与xmolNH3·H2O的中性溶液中,含有NH4+的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)A、B、C三个烧杯中分别盛有相同物质的量浓度的稀硫酸。

①B中Sn极的电极反应式为_______;Sn极附近溶液的pH(填“增大”、“减小”或“不变”)______。
②C中总反应离子方程式为_______________。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应是:_______________________。
②常温下,如果该原电池电解质溶液为pH=13的氢氧化钠500mL,构成原电池一段时间后pH变为12,则构成原电池消耗了标准状况下__________ mL甲烷,(假设化学能全部转化为电能,忽略氢氧化钠溶液的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,分别将四块形状相同、质量为7g的铁块同时投入下列四种溶液中。铁块最快溶解完的是( )
A.250.0mL2mol·L-1HClB.150.0mL2mol·L-1H2SO4
C.40.0mL5mol·L-1HClD.20.0mL18.4mol·L-1H2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂利用褐煤烟灰(主要成分为碳、二氧化锗,还有少量氧化铝和二氧化硅)制取纯GeO2的主要流程如下:

已知:GeO2是一种难溶于水的偏弱酸性的两性氧化物,GeCl4的沸点是83.1℃。
(1)写出二氧化锗与碳酸钠焙烧时发生反应的化学方程式:_______________。
(2)用水浸取焙烧物长达2小时的目的是_______________________。
(3)“酸化”至溶液中盐酸浓度为5.3 mol·L-1时有利于生成四氯化锗,写出该反应的化学方程式:_____________。
(4)若滤液“酸化”时酸度不够,溶液会出现明显的浑浊,原因是_____________________。
(5)操作“X”的名称为________________。
(6)四氯化锗与高纯水反应的化学方程式为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将V1mL未知浓度的NaOH溶液和V2mL1.50mol·L-1HCl混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50mL)。下列叙述正确的是( )
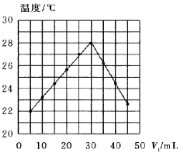
A.由图可知,做该实验时环境温度为22℃
B.该实验表明反应中化学能只能转化为热能
C.NaOH溶液的浓度约是1.00mol·L-1
D.该实验表明有水生成的反应都是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某复合肥的主要成分有KCl、NH4H2PO4和CO(NH2)2等。测定该复合肥中氮的质量分数的实验步骤如下:
步骤1:准确称取0.5000 g样品于锥形瓶中,加入足量浓硫酸并加热,不再有CO2溢出时,冷却至室温。
步骤2:向锥形瓶中加入100mL蒸馏水,再加入适量的CaCl2溶液,并用NaOH溶液调节溶液近中性,过滤,洗涤,得0.1550 gCa3(PO4)2沉淀和滤液A。
步骤3:向滤液A中加入过量的甲醛溶液,加指示剂,用0. 5000 mol/LNaOH标准溶液滴定至终点,消耗NaOH溶液22.00 mL。 [已知:4 NH4++6HCHO=4H++(CH2)6N4+6H2O]
(1)步骤1中,CO(NH2)2与硫酸反应的化学方程式为____________________。
(2)欲使滤液A中c(PO43—)≤4.0×10-6mol/L,应保持溶液中c(Ca2+)≥______________mol/L[已知KSP[Ca3(PO4)2]=2.0×10-33]。
(3)复合肥样品中N的质量分数为___________。
(4)计算复合肥样品中NH4H2PO4和CO(NH2)2的物质的量之比_____________(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年,我国科学家研发出一种新型的锌碘单液流电池,已知M为阴离子交换膜,其原理如图所示。下列说法不正确的是
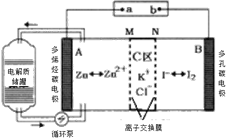
A.放电时A电极反应式为:Zn-2e﹣= Zn2+
B.充电时,B极与外接电源正极相连
C.放电时电解质储罐中离子浓度增大
D.放电时当A极减少65g时,C区Cl﹣增加2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com