
| A. | 某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性 | |
| B. | 碘水与碘化钾淀粉试纸作用出现蓝色,说明碘具有氧化性 | |
| C. | 往饱和Na2CO3溶液中通入CO2有固体析出,说明NaHCO3溶解度小于Na2CO3 | |
| D. | 同温下,等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,说明镁比铝的金属性强 |
分析 A.碱性溶液能使湿润的红色石蕊试纸变蓝;
B.碘水含碘单质,淀粉遇碘单质变蓝;
C.饱和Na2CO3溶液中通入CO2有固体析出,析出固体为溶解度小的碳酸氢钠;
D.等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,可知Al2(SO4)3水解程度大,则可知氢氧化铝的碱性弱.
解答 解:A.某气体能使湿润的红色石蕊试纸变蓝,则气体的水溶液显碱性,如气体为氨气,故A正确;
B.碘水含碘单质,淀粉遇碘单质变蓝,则碘水与碘化钾淀粉试纸作用出现蓝色,不能说明碘的氧化性,故B错误;
C.饱和Na2CO3溶液中通入CO2有固体析出,析出固体为溶解度小的碳酸氢钠,可知NaHCO3溶解度小于Na2CO3,故C正确;
D.等物质的量浓度的Al2(SO4)3比MgSO4溶液的pH小,可知Al2(SO4)3水解程度大,则可知氢氧化铝的碱性比氢氧化镁的弱,则金属性Mg>Al,故D正确;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质及检验、盐类水解及金属性比较、溶解度等,把握反应原理、物质的性质为解答的关键,侧重分析与实验能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W | T |
| 原子半径/nm | 0.186 | 0.143 | 0.102 | 0.074 | 0.071 |
| 主要化合价 | +1 | +3 | +6、-2 | -2 | -1、无正价 |
| A. | X与W形成的化合物中都只含离子键 | |
| B. | Z的氢化物与T的单质具有相同的核外电子数 | |
| C. | Y、X的最高价氧化物的水化物之间能反应 | |
| D. | Z的氧化物不止一种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
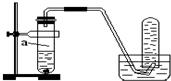 向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )
向足量的a、b两份锌粉中,分别加入少量且等量的稀H2SO4,同时向a中加入少量的CuSO4溶液.下图表示产生H2的体积(V)与时间(t)的关系,其中正确的是( )| A. | 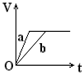 | B. | 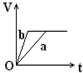 | C. | 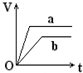 | D. | 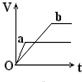 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石墨不如金刚石稳定 | |
| B. | 金刚石和石墨互为同位素 | |
| C. | 石墨能量高于金刚石 | |
| D. | 等质量的金刚石与石墨完全燃烧,石墨放出的能量少 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | υ(A)=0.20mol/(L•min) | B. | υ(B)=0.45 mol/(L•min) | ||
| C. | υ(C)=0.30 mol/(L•min) | D. | υ(D)=0.35 mol/(L•min) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径大小:Na>S>O | B. | 稳定性:HI>HBr>HCl>HF | ||
| C. | 碱性强弱:KOH>Ca(0H)2>Mg(OH)2 | D. | 还原性强弱:I一>CI一>F? |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.
已知合成氨反应N2(g)+3H2(g)?2NH3(g)△H=-92.2kJ/mol.| T/K | 473 | 573 | 673 | … |
| K | 4.4×10-2 | K1 | K2 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com