
 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑.
叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为2NaNH2+N2O=NaN3+NaOH+NH3,3NaNH2+NaNO3=NaN3+3NaOH+NH3↑. .
.分析 (1)同周期随原子序数增大元素电负性增大、元素的第一电离能呈增大趋势;
(2)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同;
(3)将1个N原子及1个单位负电荷用O原子替换,可得其等电子体;计算NO3-中N原子价层电子对数及孤电子对,确定其空间结构;
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)都含有活泼金属元素,属于离子化合物;叠氮化钠的水溶液中N3-离子发生水解,破坏水的电离平衡,溶液呈碱性;
(5)根据氨气分子之间存在氢键分析解答;
(6)①氮分子结构式为N≡N,三键含有1σ键、2个π键;
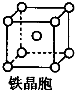
②铁晶体属于金属晶体,晶体中存在金属键;
③铁晶体为体心立方堆积,根据均摊法计算晶胞中含有2个Fe原子,结合摩尔质量计算晶胞质量,根据边长计算晶胞的体积,再根据ρ=$\frac{m}{V}$计算晶体密度.
解答 解:(1)同周期随原子序数增大元素电负性增大、元素的第一电离能呈增大趋势,故氮所在的周期中,第二周期电负性最大的元素是F,第一电离能最小的元素是Li,
故答案为:F;Li;
(2)N原子2s轨道容纳2个电子,且自旋方向相反,2p能级3个轨道各容纳1个电子,且自旋方向相同,故基态氮原子的L层电子排布图为: ,
,
故答案为: ;
;
(3)将1个N原子及1个单位负电荷用O原子替换,可得其等电子体为N2O等,NO3-中N原子价层电子对数=3+$\frac{5+1-2×3}{2}$=3、N原子不含孤电子对,故其空间结构为平面三角形,
故答案为:N2O;平面三角形;
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)都含有活泼金属Na元素,由阴、阳离子构成,属于离子化合物;叠氮化钠的水溶液中N3-离子发生水解:N3-+H2O$\stackrel{.}{?}$HN3+OH-,破坏水的电离平衡,溶液呈碱性,
贵答案为:离子晶体;N3-+H2O$\stackrel{.}{?}$HN3+OH-;
(5)N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强,故氨气的沸点较高,
故答案为:N2O分子间只存在范德华力,氨分子之间存在氢键,氢键作用较强;
(6)①氮分子结构式为N≡N,三键含有1σ键、2个π键,氮分子中σ键和π键数目之比=1:2,
故答案为:1:2;
②铁晶体属于金属晶体,晶体中存在金属键,故答案为:金属键;
③铁晶体为体心立方堆积,由其晶胞结构可知,晶胞中Fe原子数目=1+8×$\frac{1}{8}$=2,故晶胞质量=2×$\frac{56}{{N}_{A}}$g,晶胞边长为acm,则晶胞的体积=(a cm)3=a3 cm3,故晶体密度=$\frac{\frac{2×56}{{N}_{A}}}{{a}^{3}}$=$\frac{112}{{N}_{A}•{a}^{3}}$g•cm-3,
故答案为:$\frac{112}{{N}_{A}•{a}^{3}}$g•cm-3.
点评 本题考查物质结构与性质,涉及元素周期律、核外电子排布、分子构型、等电子体、晶体类型、盐类水解、化学键、晶胞计算等,题目比较综合,需要学生全面掌握基础知识,侧重主干知识的考查,是常考知识点,注意利用均摊法进行晶胞的有关计算,难度中等.


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案 南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案
南大教辅抢先起跑暑假衔接教程南京大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 硅是不活泼的非金属元素,在自然界中可以以游离态的形式存在 | |
| B. | 传统无机非金属材料和新型无机非金属材料的主要成分都是硅酸盐 | |
| C. | 铝制品在空气中有很强的抗腐蚀性是因为铝的化学性质不活泼 | |
| D. | 铝合金比纯铝的硬度更大、熔点更低 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
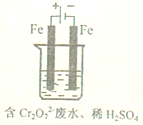 工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.
工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理.常用的处理方法有两种.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
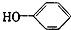 合成
合成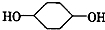 (部分试剂和反应条件已略去)
(部分试剂和反应条件已略去)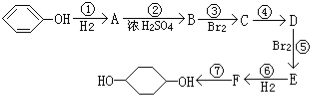
 ;F中含有官能团的名称为溴原子.
;F中含有官能团的名称为溴原子.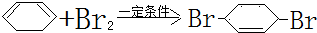 ,写出在同样反应条件下
,写出在同样反应条件下 的化学方程式(有机物写结构简式,注明反应条件)
的化学方程式(有机物写结构简式,注明反应条件)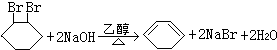 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③⑤⑥ | B. | ①⑥ | C. | ①④⑥ | D. | ②③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com