
【题目】向30mL某浓度氢氧化钠溶液中通入CO2气体后得溶液N,因CO2通入量不同,溶液N的组成也不同。若向N溶液中逐滴加入0.1mol/L盐酸,产生的气体体积V(CO2)与加入的盐酸体积V[HCl(aq)]的关系有如图所示两种情况(不计CO2的溶解),则曲线Y表明N中的溶质为_______________________, 原NaOH溶液的物质的量浓度为________;由曲线X、Y可知,两次实验通入CO2的体积之比为X:Y=___________。

【答案】 NaOH和Na2CO3 0.25mol/L 10:3
【解析】曲线X,Y开始没有气体产生,加入一定体积盐酸后生成气体,生成气体的反应为:HCO3-+H+=H2O+CO2↑,再结合反应OH-+H+=H2O、H++CO32-=HCO3-,可以知道,若X中只有Na2CO3,开始发生H++CO32-=HCO3-,前后两过程消耗HCl的体积相等,而实际开始阶段消耗盐酸体积大于产生二氧化碳消耗的盐酸体积,故Y曲线表明M中的溶质为NaOH、Na2CO3,Y曲线中,前后消耗盐酸的体积之比为1:3;则曲线X表明M中溶质为Na2CO3、NaHCO3,且二者物质的量之比为1:2;根据钠元素守恒计算原NaOH溶液的物质的量浓度;根据曲线Y生成二氧化碳消耗盐酸体积为75-60=15mL,曲线X生成二氧化碳消耗盐酸体积为75-25=50mL,求出两次实验通入CO2的体积之比。
曲线X,Y开始没有气体产生,加入一定体积盐酸后生成气体,生成气体的反应为:HCO3-+H+=H2O+CO2↑,再结合反应OH-+H+=H2O、H++CO32-=HCO3-,可以知道,若X中只有Na2CO3,开始发生H++CO32-=HCO3-,前后两过程消耗HCl的体积相等,而实际开始阶段消耗盐酸体积大于产生二氧化碳消耗的盐酸体积,故Y曲线表明M中的溶质为NaOH、Na2CO3,Y曲线中,前后消耗盐酸的体积之比为1:3;则曲线X表明M中溶质为Na2CO3、NaHCO3,且二者物质的量之比为1:2;根据钠元素守恒可以知道,当加入75mL盐酸时,溶液中的溶质为氯化钠,所以原溶液中的氢氧化钠的物质的量为0.1×0.075=0.0075mol,所以氢氧化钠的物质的量浓度为0.0075/0.03=0.25mol/L;曲线Y生成二氧化碳消耗盐酸体积为75-60=15mL,曲线X生成二氧化碳消耗盐酸体积为75-25=50mL,由HCO3-+H+=H2O+CO2↑可以知道,则两次实验通入的CO2的体积之比X:Y=50:15=10:3;正确答案:NaOH和Na2CO3 ;0.25mol/L;10:3。


科目:高中化学 来源: 题型:
【题目】海洋植物如海带、海藻中含有大量的碘元素,碘元素以碘离子的形式存在。实验室里从海藻中提取碘的流程如下图:

(1)实验室焙烧海带,需要下列仪器中的_________(填字母)。
a.试管 b.烧杯 c.坩埚 d.泥三角 e.铁三脚架 f.酒精灯
(2)指出提取碘的过程中有关的实验操作名称:①________,③________。
(3)提取碘的过程中,可选择的有机试剂是________(填字母)。
A.甲苯、酒精 B.四氯化碳、苯 C.汽油、乙酸 D.汽油、甘油
(4)小组用CCl4萃取碘水中的碘,在如图的分液漏斗中,下层液体呈________色;打开分液漏斗活塞,却未见液体流下,原因可能是___________________;

(5)实验室制取Fe(OH)3胶体化学反应方程式为____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示下列描述正确的是

A. 反应开始到10s,用Z表示的反应速率为0.158 mol/(Ls)
B. 反应开始到10s,X的物质的量浓度减少了0.79 mol/L
C. 反应开始到10s,Y的转化率为79.0 %
D. 反应的化学方程式为:X+Y![]() Z
Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度压强不变时,1mol NO2高温分解,生成NO和O2,达到平衡时容器内气体的物质的量变为1.2mol,这时NO2的转化率为
A. 10%B. 20%C. 40%D. 50%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以高硫铝土矿(主要成分为Al2O3、Fe2O3、SiO2,少量FeS2和金属硫酸盐)为原料,生产氧化铝并获得Fe3O4的部分工艺流程如下:

(1)焙烧过程均会产生SO2,用NaOH溶液吸收过量SO2的离子方程式为______________________。
(2)添加1%CaO和不添加CaO的矿粉焙烧,其硫去除率随温度变化曲线如题16图所示。

已知:多数金属硫酸盐的分解温度都高于600 ℃
硫去除率=(1—![]() )×100%
)×100%
①不添加CaO的矿粉在低于500 ℃焙烧时,去除的硫元素主要来源于__________________。
②700℃焙烧时,添加1%CaO的矿粉硫去除率比不添加CaO的矿粉硫去除率低,其主要原因是______________________________________________________。
(3)向“过滤”得到的滤液中通入过量CO2,铝元素存在的形式由_______________(填化学式)转化为_______________(填化学式)。
(4)“过滤”得到的滤渣中含大量的Fe2O3。Fe2O3与FeS2混合后在缺氧条件下焙烧生成Fe3O4和SO2,理论上完全反应消耗的n(FeS2)∶n(Fe2O3)=__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题:
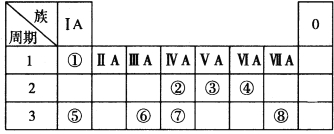
(1)地壳中含量居于第二位的元素在周期表中的位置是____。
(2)②的最高价氧化物的分子式为_____;⑦的最高价氧化物对应水化物的分子式为__。
(3)①、④、⑤三种元素可形成既含离子键又含共价键的离子化合物,该化合物的电子式为_____。
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是___(填字母,双选)。
A.最高正化合价为+6
B.气态氢化物比H2S稳定
C.最高价氧化物对应水化物的酸性比硫酸弱
D.单质在常温下可与氢气化合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关热化学方程式书写与对应表述均正确的是
A. 稀硫酸与0.1 mol/L NaOH 溶液反应:H+(aq)+OH-(aq)= H2O(l) △H = +57.3 kJ·mol1
B. 已知 2C(s)+O2(g)=2CO(g)△H= -221 kJ·mol-1,则C的燃烧热为△H =- 110.5 kJ·mol1
C. 25℃、30MPa 下,将 0.5mol N2 和 1.5molH2 置于密闭的容器中充分反应生成NH3(g),放热 19.3kJ, 其热化学方程式为:N2(g) + 3H2(g) ![]() 2NH3(g) △H= -38.6kJ·mol1
2NH3(g) △H= -38.6kJ·mol1
D. 密闭容器中,0.3mol 硫粉与 0.2mol 铁粉混合加热生成硫化亚铁 0.2mol 时,放出 19.12 kJ 热量, 则 Fe(s)+S(s)=FeS(s)△H= - 95.6 kJ·mol1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列图像的说法正确的是

A. 图 1 表示:密闭容器中发生的反应 NH2COONH4(s) 2NH3(g)+CO2(g),NH3的体积分数 ψ(NH3)与时间(t)的关系
B. 图 2 表示:一定量饱和氯水中加入 CaCO3 固体,溶液中的 c(Cl-)与加入 CaCO3 物 质的量关系
C. 图3表示:NH4HSO4溶液中加入NaOH固体,溶液中的c(NH4+)与加入NaOH质量 的关系
D. 图4表示:25℃时,Na2S溶液加水稀释,溶液中的c(H+)与加入水的体积的关系
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com