
| 水解反应 | 平衡常数(K) |
| Fe3++3H2O?Fe(OH)3+3H+ | 7.9×10-4 |
| Fe2++2H2O?Fe(OH)2+2H+ | 3.2×10-10 |
| Cu2++2H2O?Cu(OH)2+2H+ | 3.2×10-7 |
| 实验内容 | 实验现象 |
| 甲同学的实验方案 | 溶液逐渐变成蓝绿色,pH略有上升 |
| 乙同学的实验方案 | 无明显现象,pH没有明显变化. |
分析 (1)稀硝酸和Cu反应生成硝酸铜、NO和水;
(2)铁离子水解呈酸性,如验证乙同学的看法是否正确,可测定0.5mol/L Fe(NO3)3溶液的pH,然后在硝酸钠溶液中滴加盐酸,与硝酸铁溶液PH相同、硝酸根离子浓度相同,加入铜观察是否反应;
(3)甲同学的实验方案中溶液逐渐变成蓝绿色,pH略有上升,说明铁离子氧化铜,注意比较离子水解的程度;乙同学的实验方案无明显现象,pH没有明显变化,说明不反应;
(4)如证明铁离子氧化铜,可排除硝酸根离子的影响,应用其它可溶性铁盐.
解答 解:(1)稀硝酸和Cu反应生成硝酸铜、NO和水,反应的方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,
故答案为:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
(2)铁离子水解呈酸性,如验证乙同学的看法是否正确,可测定0.5mol/L Fe(NO3)3溶液的pH,然后在硝酸钠溶液中滴加盐酸,与硝酸铁溶液PH相同、硝酸根离子浓度相同,做法是测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应,
故答案为:测定硝酸铁溶液的pH,再用硝酸钠溶液和稀盐酸配制成与硝酸铁溶液PH相同、硝酸根离子浓度相同的溶液,将铜片加入到该溶液中,观察二者是否反应;
(3)①甲同学的实验方案中溶液逐渐变成蓝绿色,pH略有上升,说明铁离子氧化铜,反应的离子方程式为Cu+2Fe3+=Cu2++2Fe2+,
故答案为:Cu+2Fe3+=Cu2++2Fe2+;
②因Fe3+ 变为Cu2+和Fe2+,水解能力下降,导致实验过程中溶液pH略有上升,
故答案为:Fe3+ 变为Cu2+和Fe2+,水解能力下降;
③乙同学的实验方案无明显现象,pH没有明显变化,说明不反应,
故答案为:在此酸性条件下NO3-不能氧化Cu;
(4)如证明铁离子氧化铜,可排除硝酸根离子的影响,应用其它可溶性铁盐,如0.5mol/L氯化铁溶液,
故答案为:将铜片放入0.5mol/L氯化铁溶液中.
点评 本题以硝酸铁的性质探究为载体考查物质的性质实验,为高考常见题型,侧重学生的分析能力和实验能力的考查,注意把握实验的严密性和实验原理的评价,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 该温度高于25℃ | |
| B. | 由水电离出来的H+的浓度是1.0×10-12 mol•L-1 | |
| C. | 加入NaHSO4晶体抑制了水的电离 | |
| D. | c(H+)=c(OH-)+c(SO42-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

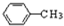 .
. .
.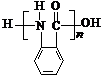 的单体.
的单体.
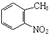 ,试剂a为酸性高锰酸钾溶液.
,试剂a为酸性高锰酸钾溶液.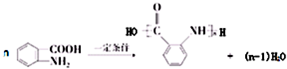 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lNA | B. | 2NA | C. | 3NA | D. | 0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,6.72L NO2与水充分反应转移的电子数目为0.2NA | |
| B. | 1mo1的Fe在1mo1Cl2中充分燃烧,转移电子数为3NA | |
| C. | 7.2g CaO2中的阴离子含有的电子数为1.0NA | |
| D. | 标准状况下,22.4L盐酸含有2NA个离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 编号 | 实验 | 现象 |
| ① | 放入蒸馏水 | 木条燃烧 |
| ② | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 方便添加木柴 | B. | 升高木柴的温度 | ||
| C. | 降低木柴的着火点 | D. | 使木柴与空气充分接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2O2的电子: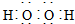 | |
| B. | 乙烯的结构简式:CH2CH2 | |
| C. | S2-离子的结构示意图: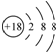 | |
| D. | FeSO4的电离方程式:FeSO4═Fe3++SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com