
| 实验 | 温度/℃ | 起始时 | 平衡时 | |||
| n(CO)/mol | n(H2S)/mol | n(COS)/mol | n(H2)/mol | n(CO)/mol | ||
| 1 | 150 | 10.0 | 10.0 | 0 | 0 | 7.0 |
| 2 | 150 | 7.0 | 8.0 | 2.0 | 4.5 | a |
| 3 | b | 20.0 | 20.0 | 0 | 0 | 16.0 |
| A. | 实验1反应开始到平衡整个过程中转移的电子的物质的量为6mol | |
| B. | 实验2达平衡时,a>7.0 | |
| C. | 实验3温度b>150 | |
| D. | 实验3 CO平衡转化率比实验1小 |
分析 A.由表格中数据可知,参加反应的CO为10mol-7mol=3mol,C元素的化合价由+2价升高为+4价;
B.为可逆反应,H2S可促进CO的转化;
C.实验1、3相比,起始物质的量为2倍关系,但增大压强平衡不移动,平衡时实验3中CO物质的量大于实验1中CO物质的量的2倍;
D.结合选项C可知,升高温度平衡逆向移动.
解答 解:A.由表格中数据可知,参加反应的CO为10mol-7mol=3mol,C元素的化合价由+2价升高为+4价,则转移电子为3mol×(4-2)=6mol,故A正确;
B.为可逆反应,H2S可促进CO的转化,则实验2达平衡时,0<a<7.0,故B错误;
C.实验1、3相比,起始物质的量为2倍关系,但增大压强平衡不移动,平衡时实验3中CO物质的量大于实验1中CO物质的量的2倍,则实验3温度b>150,故C正确;
D.结合选项C可知,实验3温度高,升高温度平衡逆向移动,则实验3 CO平衡转化率比实验1小,故D正确;
故选B.
点评 本题考查化学平衡的计算,为高频考点,把握表格中数据应用、温度和压强对反应的影响为解答的关键,侧重分析与应用能力的考查,注意选项C为解答的难点,题目难度不大.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 分散质粒子半径介于1nm~100nm之间的分散系称为胶体 | |
| B. | 胶体粒子很小,可以稳定存在的原因是胶粒的布朗运动 | |
| C. | 容量瓶用蒸馏水洗涤后残留有少量的水,将导致配制结果不变 | |
| D. | 检验某溶液是否含有SO42-时,应取少量该溶液,依次加入BaCL2溶液和稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
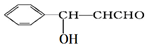 中含有的官能团为羟基,醛基.
中含有的官能团为羟基,醛基.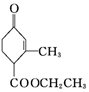 中含有的官能团名称是羰基(酮基),碳碳双键,酯基.
中含有的官能团名称是羰基(酮基),碳碳双键,酯基.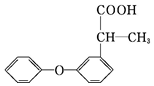 中的含氧官能团是醚键,羧基.
中的含氧官能团是醚键,羧基.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在水溶液中的沉淀溶解平衡方程式是AgCl(s)?Ag+(aq)+Cl-(aq) | |
| B. | AgCl在水溶液中的电离方程式是AgCl=Ag++Cl- | |
| C. | 反应aA(g)?bB(g)+cC(g)达到平衡以后,增大A的物质的量浓度,A的转化率一定减小 | |
| D. | 钢铁发生电化学腐蚀时负极反应式为Fe-e-=Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
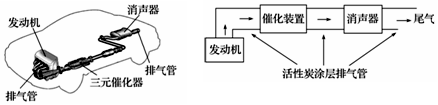
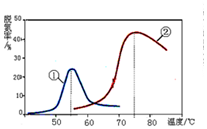
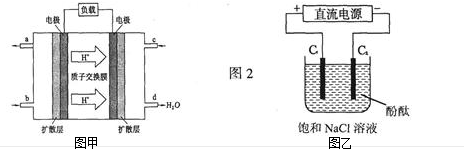
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
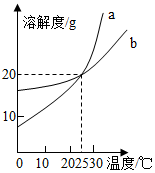
| A. | a的溶解度大于b的溶解度 | |
| B. | 在20℃时,a、b的溶液中溶质的质量分数相同 | |
| C. | b的溶解度都随温度升高而增大 | |
| D. | b都属于易溶物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com