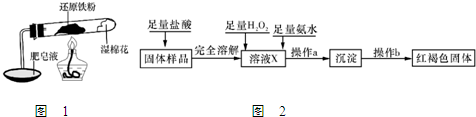
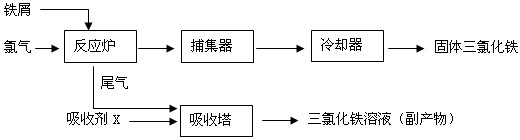
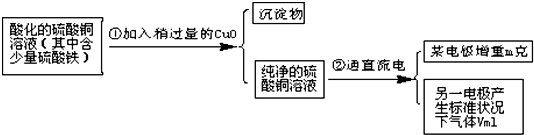
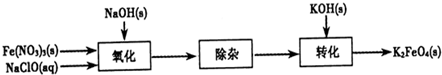
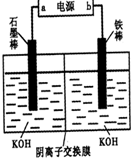
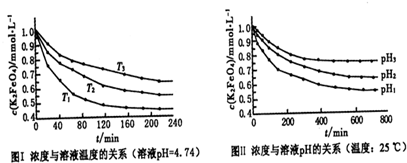
���Ȼ�������ѧ��ѧʵ�����г��õĻ�ѧ�Լ���ijͬѧ���÷���м��������ͭ�Ȳ������ᷴӦ�����ʣ����Ʊ�FeCl
3?6H
2O����ͬѧ��Ƶ�ʵ��װ����ͼ��ʾ����ʵ�鲽�����£�A�з��з���м���ձ���ʢ�й�����ϡ���ᣬʵ��ʱ��a���ر�b���ӷ�Һ©������A�мӹ��������ᣬ��ʱ��Һ��dz��ɫ���ٴ�b���й��ˣ����˽�����ȡ�ձ�����Һ������������ȣ�����������ˮ��ʹʣ��HNO
3�ֽ⣬�ٽ��½ᾧ��FeCl
3?6H
2O���壮��д���пհף�
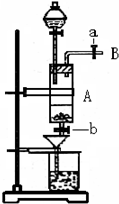
��1���ռ�����B��������ɲ��õķ�����
����ˮ���������ſ�����
����ˮ���������ſ�����
���μ�����ʱ�����ַ�Ӧ���ʽ�֮�����봿���۷�ӦҪ�죬��ԭ����
�����м�к�����Cu�����ʣ��γ�Fe-Cuԭ���ʹ��Ӧ���ʼӿ�
�����м�к�����Cu�����ʣ��γ�Fe-Cuԭ���ʹ��Ӧ���ʼӿ�
��
��2���ձ��ڷŹ���ϡHNO
3��ԭ����
ϡHNO3��ǿ�����ԣ�Ϊ��֤ʹFe2+ ȫ��������Fe3+
ϡHNO3��ǿ�����ԣ�Ϊ��֤ʹFe2+ ȫ��������Fe3+
��������Ӧ�����ӷ���ʽ��
3 Fe2++4H++NO3-�T3 Fe3++NO��+2H2O
3 Fe2++4H++NO3-�T3 Fe3++NO��+2H2O
��
��3������ʵ������У����ɼ�a���������Ϊ�ų������������⣬��һ��Ŀ����
�������ͨ��ʹ��Һ©���е���ɵ���A��
�������ͨ��ʹ��Һ©���е���ɵ���A��
��
��4�����ձ�����Һ��������Ũ�����ٽ��½ᾧ���Ƶ�FeCl
3?6H
2O��������ֱ�����ɵķ������Ƶþ����������
��ΪFeCl3��ǿ��������ˮ�⣺FeCl3+3H2O?Fe��OH��3+3HCl����������ʱʹHCl�ӷ����ˮ��ƽ�����ƣ���˵ò���FeCl3?6H2O
��ΪFeCl3��ǿ��������ˮ�⣺FeCl3+3H2O?Fe��OH��3+3HCl����������ʱʹHCl�ӷ����ˮ��ƽ�����ƣ���˵ò���FeCl3?6H2O
��5������Ϊ��ʵ����ڵ�ȱ������У�
��Ӧ�в������к��������Ⱦ��������ϡHNO3����FeCl2ʱ����Fe��NO3��3���ɶ�ʹ�Ƶõ�FeCl3?6H2O����
��Ӧ�в������к��������Ⱦ��������ϡHNO3����FeCl2ʱ����Fe��NO3��3���ɶ�ʹ�Ƶõ�FeCl3?6H2O����
��



 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�