
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.18g重水(D2O)所含的电子数为10NA
B.22.4LCl2通入水中充分反应,共转移NA个电子
C.1L 1mol·L-1 NaF溶液中Fˉ的数目小于NA
D.25℃ 时,pH=13的1.0L Ba(OH)2溶液中含有的OH-数目为0.2NA
 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案科目:高中化学 来源:2015届广东省佛山市高三10月月考化学试卷(解析版) 题型:选择题
镍镉(Ni—Cd)可充电电池在现代生活中有广泛应用。已知某镍镉电池的电解质溶液为KOH溶液,其充、放电按下式进行:Cd +2iOOH + 2H2O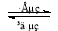 Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
Cd(OH)2 + 2Ni(OH)2。有关该电池的说法正确的是
A.充电时阳极反应:Ni(OH)2 - e- + OH- = NiOOH + H2O
B.充电过程是电能转化为化学能的过程
C.放电时负极附近溶液的碱性不变
D.放电时电解质溶液中的OH-向正极移动
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市高三上学期第二次模拟考试化学试卷(解析版) 题型:选择题
下列关于物质应用的说法错误的是( )
A.玻璃容器可长期盛放各种酸 B.纯碱可用于清洗油污
C.浓氨水可检验氯气管道漏气 D.通过浓硫酸除去NH3中的H2O
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:实验题
(15分)实验室常用的几种气体发生装置如图A、B、C所示:
(1)实验室可以用B或C装置制取氨气:
Ⅰ、如果用B装置,通常使用的药品是________________;
Ⅱ、如果用C装置,通常使用的药品是________________________;
Ⅲ、检查B装置气密性的操作方法是____________________________________________。
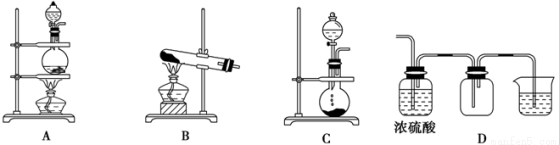
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是_____(填序号,下同)。
①密度 ②颜色 ③溶解性 ④热稳定性 ⑤与氧气反应
下图是某学生设计收集气体的几种装置,其中不可行的是________。
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的________。
①CO2 ②NO ③Cl2 ④H2
Ⅰ、写出A装置中反应的离子方程式____________________________________。
Ⅱ、D装置中连接小烧杯中应盛放___________,目的是_____________________________。
Ⅲ、若要收集干燥纯净的X气体,上述装置应如何改进:____________________________________。
查看答案和解析>>
科目:高中化学 来源:2015届广东省中山市等五校联考高三第一学期化学试卷(解析版) 题型:选择题
下列陈述Ⅰ、Ⅱ正确并且有因果关系的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ |
A | H2O2有氧化性 | H2O2能使酸性高锰酸钾溶液褪色 |
B | Al既可和酸反应又可和强碱反应 | Al可制成铝箔包装物品 |
C | K2FeO4能与水作用生成Fe(OH)3胶体和O2 | K2FeO4可用于净化自来水并杀菌消毒 |
D | 铜表面易形成致密的氧化膜 | 铜板上的铁钉在潮湿空气中不易生锈 |
查看答案和解析>>
科目:高中化学 来源:2015届广东省东莞市高三第一次调研考试理科化学试卷(解析版) 题型:填空题
(16分)高纯六水氯化锶晶体(SrCl2·6H2O)具有很高的经济价值,工业上用难溶于水的碳酸锶(SrCO3)为原料(含少量钡和铁的化合物等),制备高纯六水氯化锶晶体的过程为:
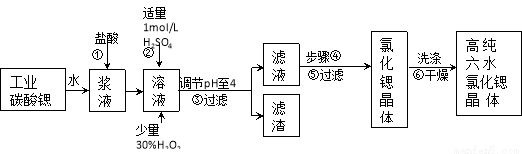
已知: Ⅰ. SrCl2·6H2O 晶体在61℃时开始失去结晶水,100℃时失去全部结晶水。
Ⅱ.有关氢氧化物开始沉淀和完全沉淀的pH表:
氢氧化物 | Fe(OH)3 | Fe(OH)2 |
开始沉淀的pH | 1.5 | 6.5 |
沉淀完全的pH | 3.7 | 9.7 |
(1)操作①加快反应速率的措施有 (写一种)。碳酸锶与盐酸反应的离子方程式 。
(2)酸性条件下,加入30% H2O2溶液,将Fe2+氧化成Fe3+,其离子方程式为 。
(3)在步骤②-③的过程中,将溶液的pH值由1调节至4时,宜用的试剂为_______。
A.氨水 B.氢氧化锶粉末 C. 氢氧化钠 D.碳酸钠晶体
(4)操作③中所得滤渣的主要成分是 (填化学式)。
(5)步骤④的操作是 、 。
(6)工业上用热风吹干六水氯化锶,适宜的温度是 。
A.50~60℃ B.70~80℃ C.80~100℃ D.100℃以上
查看答案和解析>>
科目:高中化学 来源:2015届广东省东莞市高三第一次调研考试理科化学试卷(解析版) 题型:选择题
在短周期中,R原子最外层电子数是其次外层电子数的3倍,下列说法不正确的是
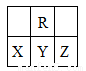
A.原子半径大小:X >Y>Z
B.氢化物的稳定性:X >Y
C.化合物YR2能使品红溶液褪色
D.X、Y、Z三种元素最高价氧化物的水化物的酸性最强的是Z
查看答案和解析>>
科目:高中化学 来源:2015届山西省高三上学期期中考试化学试卷(解析版) 题型:填空题
(12分)过氧化钙可以用于改善地表水质、处理含重金属粒子废水和治理赤潮,也可用于应急供氧等。工业上生产过氧化钙的主要流程如下:
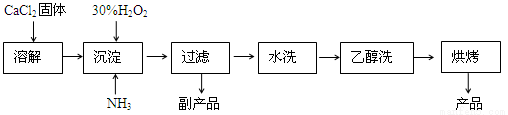
已知CaO2·8H2O呈白色,微溶于水,加热至350℃左右开始分解放出氧气。
(1)用上述方法制取CaO2·8H2O的化学方程式是 。
(2)沉淀时常用冰水控制温度在0℃左右,其可能原因是(写出两种):
① ;② 。
(3)测定产品中CaO2的含量的实验步骤是:
第一步:准确称取a g产品于有塞锥形瓶中,加入适量蒸馏水和过量的b g KI晶体,再滴入少量2 mol/L的H2SO4溶液,充分反应。
第二步:向上述锥形瓶中加入几滴淀粉溶液。
第三步:逐滴加入浓度为c mol·L-1的Na2S2O3溶液至反应完全,消耗Na2S2O3溶液V mL。
【己知:I2+2S2O32-=2I-+S4O62-】
①CaO2的质量分数为 (用字母表示);
②某同学第一步和第二步的操作都很规范,第三步滴速太慢,这样测得的CaO2的质量分数可能 (填“不受影响”、“偏低”或“偏高”),原因是 。
查看答案和解析>>
科目:高中化学 来源:2015届山东省高三上学期第二次月考联考化学试卷(解析版) 题型:选择题
已知反应:KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O,据此判断下列说法正确的是
A.反应生成物都属于电解质 B.HCl全部发生氧化反应
C.该反应表明氧化性KClO3比Cl2强 D.1mol KClO3在反应中得到6mole-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com