
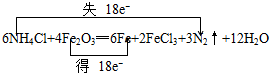 (或
(或 );
);分析 (1)根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物,利用元素守恒来分析X;
(2)根据Fe元素的化合价降低、N元素的化合价升高,利用电子守恒及质量守恒定律来配平反应,然后标出电子转移的分析和数目;
(3)该反应中,S2O82-中O元素的化合价若为-2价,则S元素的化合价为+7,而S元素的最高正价为+6价,则O氧元素的化合价为-1价,S2O82-中S元素的化合价为+4价,该反应中O元素得到电子被还原,Mn、S元素失去电子被氧化,据此进行解答.
解答 解:(1)根据焊药为氯化铵,其作用是消除焊接处的铁锈可知反应物为NH4Cl、Fe2O3,
则该反应得生成物为FeCl3、N2、Fe和X,
根据元素守恒可知X中含有H、O元素,则X为H2O,
故答案为:H2O;
(2)由反应物和生成物可知,NH4Cl+Fe2O3→Fe+FeCl3+N2↑+H2O,该反应Fe元素的化合价由+3价降低为0,N元素的化合价由-3价升高到0,
根据电子守恒可知,得电子数=失去电子数=18e-,则6NH4Cl+Fe2O3→6Fe+FeCl3+3N2↑+H2O,再质量守恒定律可知,配平的化学反应为6NH4Cl+4Fe2O3═6Fe+2FeCl3+3N2↑+12H2O,用双线桥电子转移的方向和数目可以表示为: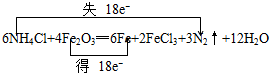 ,用单线桥表示电子转移的方向和数目为:
,用单线桥表示电子转移的方向和数目为: ,
,
故答案为: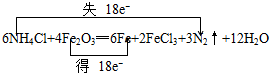 (或
(或 );
);
(3)反应5S2O82-+2Mn2++8H2O=10SO42-+2MnO4-+16H+中,S2O82-中O元素的化合价若为-2价,则S元素的化合价为+7,而S元素的最高正价为+6价,则O氧元素的化合价为-1价,S2O82-中S元素的化合价为+4价,该反应中O元素得到电子被还原,Mn、S元素失去电子被氧化;
5molS2O82-参加反应时,被还原的-1价O元素的物质的量为5mol×2=10mol,则转移电子物质的量为:10mol×1=10mol
故答案为:O;10mol.
点评 本题考查了氧化还原反应的计算,题目难度中等,涉及氧化还原反应的配平、计算,明确氧化还原反应的实质为解答关键,注意掌握用单线桥、双线桥分析氧化还原反应的方法,试题培养了学生的灵活应用能力.


科目:高中化学 来源: 题型:解答题
 在人类社会的发展进程中,金属起着重要的作用.
在人类社会的发展进程中,金属起着重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通直流电后,溶液中溶质分子分别向两极移动,而胶体中分散质粒子向某一极移动 | |
| B. | 向Fe(OH)3胶体中不断滴加稀硫酸,最终胶体聚沉产生红褐色沉淀 | |
| C. | 硫酸铜溶液通过一束光无特殊现象,淀粉溶液中通过一束光侧面出现一条光亮的通路 | |
| D. | 溶液中溶质粒子的运动有规律,胶体粒子运动无规则 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X/m mol | B. | 2X/3mol | C. | (X+Y)mol | D. | 2(X+Y)/3mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙炔分子的比例模型示意图: | B. | 2-甲基-2-戊烯的键线式: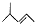 | ||
| C. | 乙醇的结构简式:CH3CH2OH | D. | 1,3-丁二烯的分子式:C4H8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
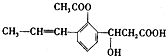 ,下列有关该有机化合物的说法不正确的是
,下列有关该有机化合物的说法不正确的是| A. | 含有四种官能团 | |
| B. | 能发生取代、加成、消去、氧化等反应• | |
| C. | 1mol该有机物最多可以与2molNaOH反应 | |
| D. | 该有机物属于芳香族化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com