
菠菜营养丰富,素有“蔬菜之王”之称,是一种高效的补铁剂。长期以来民间流传“菠菜不能与豆腐同食”、“菠菜根比菠菜茎和叶更有营养”等说法。某学校化学兴趣小组的同学拟通过实验探究以下问题:
①菠菜是否含有丰富的铁?
②菠菜是否含有草酸类物质?
③菠菜根中铁的含量是否比菠菜茎和叶中的高?
通过上网查询,获得以下资料:草酸又名乙二酸,其酸性比乙酸稍强,草酸及其盐具有较强的还原性,其中草酸钙不溶于水。
他们设计的实验步骤如下:
Ⅰ.
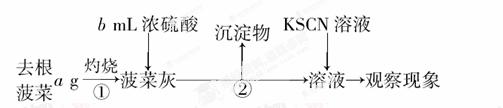
Ⅱ.取菠菜根a g,使用相同仪器、试剂,重复I中实验,观察实验现象。
Ⅲ.将菠菜在少量开水中煮沸2~3 min,冷却后滤去菠菜,得滤液。向滤液中加入足量Ca(OH)2溶液,然后再加入足量试剂X,观察现象。
请回答以下问题:
(1)操作①中使用的仪器除三脚架、酒精灯、玻璃棒外还需要________,操作②的名称是________。
(2)可以说明菠菜根中Fe元素含量要比菠菜茎和叶中多的现象是________。
(3)菠菜中的Fe是+2价还是+3价?________。
(4)通过步骤Ⅲ可以确定菠菜中含有草酸类物质。由于滤液中含有CO32-,故需加入试剂X排除CO32-的干扰。则X是________(写化学式),加入试剂X后观察到的现象是________。
科目:高中化学 来源: 题型:
在密闭容器中进行如下反应:H2(g)+I2(g)  2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示,符合图示的正确判断是
2HI(g),在温度T1和T2时,产物的量与反应时间的关系如右图所示,符合图示的正确判断是
A.T1>T2,ΔH>0 B.T1>T2,ΔH<0
C.T1<T2,ΔH>0 D.T1<T2,ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为2 L的 密闭容器中,保持体系内温度800 ℃不变,将一定量的NO和O2混合发生反应:
密闭容器中,保持体系内温度800 ℃不变,将一定量的NO和O2混合发生反应:
2NO+O22NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示。请回答下列问题。
(1)30 s时反应达到平衡,用O2表示达到平衡过程的平均反应速率为
________,图像中曲线______ __(选填“Ⅰ”或“Ⅱ”)表示NO2的变化。由图像中曲线和数据变化,能否计算该温度下的平衡常数:____________(填“能”或“不能”)。
__(选填“Ⅰ”或“Ⅱ”)表示NO2的变化。由图像中曲线和数据变化,能否计算该温度下的平衡常数:____________(填“能”或“不能”)。
(2)若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是________热反应(选填“吸”或“放”)。
(3)在800 ℃时,若缩小容器的体积,达新平衡时n(NO)________(选填“>”、“=”或“<”)0.07 mol,NO的转化率________(选填“增大”、“不变”或“减小”)。
(4)上述800 ℃时的反应达到平衡时测得放出热量a kJ。试写出在此条件下NO与氧气反应的热化学方程式________________________________________ __________________________。
__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一。某研究小组进行如下实验:
实验一 焦亚硫酸钠的制取
采用右图装置(实验前已除尽装置内的空气)制取Na2S2O5。装置II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
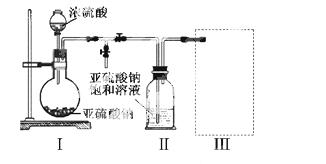
(1)装置I中产生气体的化学方程式为 。
(2)要从装置 II中获得已析出的晶体,可采取的分离方法是 。
II中获得已析出的晶体,可采取的分离方法是 。
(3)装置III用于处理尾气,可选用的最合理装置(夹持仪器已略去)为 (填序号)。

实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3。
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是 (填序号)。
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸
d.加入品红溶液 e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是  。
。
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂。测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:

(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00 mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算 )为 g·L-1。
)为 g·L-1。
②在上述实验过程中,若有部分HI被空气氧化,则测得结果 (填“偏高”“偏低”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
中学化学教材中有大量数据,下列是某同学对数据的利用情况,其中正确的是( )
A.利用焓变的数据或熵变的数据一定都能单独判断反应是否能自发进行
B.利用沸点数据推测将一些液体混合物分离开来的可能性
C.利用反应热数据的大小判断不同反应的反应速率的大小
D.利用溶液的pH与7的大小关系,来判断任何温度下溶液的酸碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
MnO2在酸性溶液中具有强氧化性,可被还原为Mn2+,它还对H2O2的分解具有良好的催化效果。某兴趣小组通过实验研究MnO2的性质。
(1)该小组设计了如下4个方案以验证MnO2的氧化性,可行的是________。
A.把MnO2固体加入到FeSO4溶液中,再加入KSCN溶液,观察溶液是否变红
B.把MnO2固体加入到FeCl3溶液中,再加入KSCN溶液,观察溶液是否变红
C.把MnO2固体加入到Na2SO3溶液中,再加入BaCl2溶液,观察是否有白色沉淀生成
D.把MnO2固体加入到稀盐酸中,观察是否有黄绿色气体生成
(2)该小组为研究在不同酸碱性的溶液中MnO2的氧化能力,他 们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
们控制KI溶液的浓度和MnO2固体的质量相同,恒定实验温度在298 K,设计如下对比实验。
| 实验 | 酸或碱[ | 现象 |
| A | 1滴0.2 mol/L NaOH溶液 | 不变色 |
| B | 1滴水 | 缓慢变浅棕褐色 |
| C | 1滴0.1 mol/L硫酸 | 迅速变棕褐色 |
该小组从上述对比实验中,可以得出的结论是____________________________
__________________________________________________。
写出在酸性条件下,MnO2氧化I-的离子方程式_____________________________
__________________________________________________。
(3)为了探究MnO2的催化效果,需要用30%的H2O2溶液(密度近似为1 g/cm3)配制浓度约为3%的H2O2溶液(密度近似为1 g/cm3)100 mL。其配制方法是:用量筒量取________mL 30% H2O2溶液放入________(填仪器名称)中,再加入一定量的水,搅拌均匀。
(4)在实验时,某同学把1滴KI溶液误滴入到过量的5 mL 3%的H2O2溶液中,发现产生了大量气泡。该小组查阅到KI与H2O2可发生如下反应:2KI+H2O2===2KOH+I2,认为有可能是反应产物I2起了催化H2O2分解的作用。请设计一个简单实验证明该假设是否正确________。
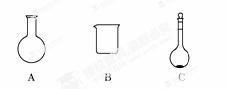
(5)实验室用二氧化锰和浓盐酸共热制取氯气,下列仪器可作为该反应的反应容器的是________(填序号)。
(6)二氧化锰可用于制作干电池,电池总反应为:Zn+2MnO2+2NH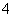 ===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
===Zn2++Mn2O3+2NH3+H2O,则其正极的电极反应式为________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
氨是一种重要的化工产品,是氮肥工业、有机合成工业以及制造硝酸、铵盐和纯碱等的原料。
(1)以氨为燃料可以设计制造氨燃料电池,因产物无污染,在很多领域得到广泛应用。若电极材料均为惰性电极,KOH溶液作电解质溶液,则该电池负极电极反应式为 。
(2)在一定温度下,在固定体积的密闭容器中进行可逆反应:N2+3H2 2NH3。该可逆反应达到平衡的标志是________________。
2NH3。该可逆反应达到平衡的标志是________________。
A.3v(H2)正=2v(NH3)逆
B.单位时间生成m mol N2的同时消耗3m mol H2
C.容器内的总压强不再随时间而变化
D.混合气体的密度不再随时间变化
E.a molN≡N键断裂的同时,有6amolN—H键断裂
F.N2、H2、NH3的分子数之比为1∶3∶2
(3)某化学研究性学习小组模拟工业合成氨的反应。在容积固定为2L的密闭容器内充入1molN2和3molH2,加入合适催化剂(体积可以忽略不计)后在一定温度压强下开始反应,并用压力计监测容器内压强的变化如下:
| 反应时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强/MPa | 16.80 | 14.78 | 13.86 | 13.27 | 12.85 | 12.60 | 12.60 |
则从反应开始到25min时,以N2表示的平均反应速率= ;该温度下平衡常数K= ;
(4)以CO2与NH3为原料合成尿素[化学式为CO(NH2)2]的主要反应如下,已知:
①2NH3(g)+CO2(g) == NH2CO2 NH4(s) △H= —l59.5 kJ·mol-1
②NH2CO2NH4(s)  CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
CO(NH2)2(s)+H2O(g) △H=+116.5 kJ·mol-1
③H2O(1) == H2O(g) △H=+44.0kJ·mol-1
写出CO2与NH3合成尿素和液态水的热化学反应方程式 ;
对于上述反应②在密闭容器中将过量NH2CO2NH4固体于300K下分解,平衡时P[H2O(g)]为a Pa,若反应温度不变,将体系的体积增加50%,则P[H2O(g)]的取值范围是_________________(用含a的式子表示)。(分压=总压×物质的量分数)
查看答案和解析>>
科目:高中化学 来源: 题型:
向一定量的Mg2+、NH4+、Al3+混合溶液中加入Na2O2的量与生成沉淀和气体的量(纵坐标)的关系如图所示,则溶液中Mg2+、NH4+、Al3+三种离子的物质的量之比为( )。
A.1∶1∶2 B. 2∶2∶1
C. 1∶2∶2 D.9∶2∶4
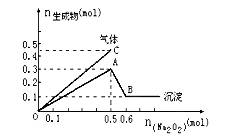
查看答案和解析>>
科目:高中化学 来源: 题型:
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由如图2-1-1表示,在下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是( )。
A. ①④ B. ③④ C. ①②③ D. ②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com