
| 元素代号 | A | B | C | D | E |
| 原子半径/nm | 0.160 | 0.143 | 0.102 | 0.099 | 0.074 |
| 主要化合价 | +2 | +3 | +6、-2 | +7、-1 | -2 |
分析 短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有+7、-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al,据此解答.
解答 解:短周期元素中,C、E都有-2价,处于ⅥA族,C有+6价且原子半径C>E,故C为硫、E为氧;D有+7、-1价,原子半径大于氧,故D为Cl;A、B化合价分别为+2、+3,分别处于ⅡA族、ⅢA族,原子半径A>B>硫,故A为Mg、B为Al.
(1)B为Al元素,处于周期表中第三周期ⅢA族,故答案为:三;ⅢA;
(2)上述五种元素的最高价氧化物对应水化物中酸性最强的是HClO4,故答案为:HClO4;
(3)B、E形成的化合物为Al2O3,故答案为:Al2O3.
点评 本题考查结构性质位置关系综合应用,根据原子半径与化合价推断元素是解题关键,注意对元素周期律的理解掌握.


科目:高中化学 来源: 题型:选择题
| A. | PH4I加热易分解,且可产生紫红色气体 | |
| B. | PH4I很稳定,加热不易分解 | |
| C. | PH4I不能与NaOH反应 | |
| D. | PH4I不能由PH3与HI化合生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:
硫酸亚铁晶体(FeSO4•7H2O)在医药上作补血剂.某课外小组的同学欲测定该补血剂中铁元素的含量.实验步骤如图:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
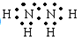 ,过氧化氢的结构式:
,过氧化氢的结构式: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | M分子式为C6H6O7 | |
| B. | 1 mol物质M可以和3 mol氢气发生加成 | |
| C. | M分子不可以发生消除反应 | |
| D. | 足量的M分别与等物质的量的NaHCO3、Na2CO3反应得到的气体物质的量相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H<0 | |
| B. | 镀锡铁制品镀层破损后,铁制品比受损前更容易生锈,而镀锌铁制品则相反 | |
| C. | 将纯水加热至较高温度,K变大、pH变小、呈酸性 | |
| D. | 给0.1mol•L-1CH3COOH溶液中加热,则c(H+)与c(CH3COOH)的比值增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙烯、丙烯 | B. | 甲醇、乙二醇 | C. | 乙炔、苯 | D. | 丙烯、环丙烷 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
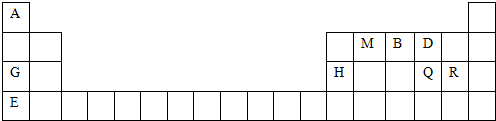
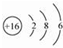
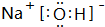 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程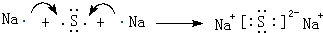 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com