
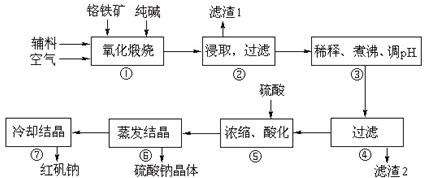
| ||
| ||
| ||
| 2.384g |
| 2.5g |


科目:高中化学 来源: 题型:
| A、钠的还原性很强,可以用来冶炼金属钛、锆、铌等 |
| B、纯铁比生铁的耐腐蚀性强 |
| C、铝是比较活泼金属,不能用铝制容器盛放冷的浓硫酸 |
| D、将铜放入稀硫酸中不溶解,再加入一些硝酸钾溶液铜就可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见如图).分析图象得到的以下结论中,一定正确的是( )
某兴趣小组为探究活泼金属与酸反应的规律,将质量相等的甲、乙两种金属分别放入到质量分数相同的足量稀盐酸中,经实验测定并绘制出生成氢气的质量与反应时间的关系(见如图).分析图象得到的以下结论中,一定正确的是( )| A、金属甲比金属乙活泼 |
| B、金属甲比金属乙的相对原子质量大 |
| C、金属乙比金属甲与盐酸的反应速率大 |
| D、金属乙比金属甲的化合价高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制备AlCl3、FeCl3、CuCl2均不能采用将溶液直接蒸干的方法 |
| B、三者的单质放置在空气中均只生成氧化物 |
| C、三者对应的氧化物均为碱性氧化物 |
| D、电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、FeS和CuS |
| B、FeS |
| C、CuS |
| D、Al2S3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com