
【题目】使①蔗糖、②淀粉、③纤维素、④乙酸乙酯在稀硫酸存在下分别进行水解,最终产物只有1种的是( )。
A.①②B.①③C.④D.②③
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】氢气作为清洁能源有着广泛的应用前景,含硫天然气制备氢气的流程如下。

请回答下列问题:
I.转化脱硫:将天然气压入吸收塔,30℃时,在T.F菌作用下,酸性环境中脱硫过程示意图如下。
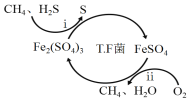
(1)过程i的离子反应方程式为_________________________________________。
(2)已知:
①Fe3+在pH=l.9时开始沉淀,pH=3.2时沉淀完全。
②30℃时,在T.F菌作用下,不同pH的FeSO4溶液中Fe2+的氧化速率如下表。
pH | 0.7 | 1.1 | 1.5 | 1.9 | 2.3 | 2.7 |
Fe2+的氧化速率/g·L-1·h-1 | 4.5 | 5.3 | 6.2 | 6.8 | 7.0 | 6.6 |
在转化脱硫中,请在上表中选择最佳pH范围是_______<pH<_______,这样选择的原因是:_______________________________________________。
Ⅱ.蒸气转化:在催化剂的作用下,水蒸气将CH4氧化。结合下图回答问题。
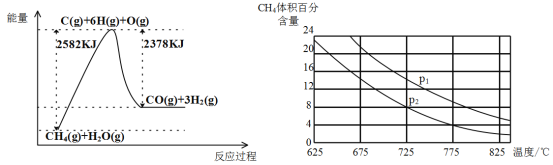
(3)①该过程的热化学方程式是__________________________________________。
②比较压强P1和p2的大小关系:P1 _________ P2(选填“>”“<”或“=”)。
③在一定温度和一定压强下的体积可变的密闭容器中充入1molCH4和1mol的水蒸气充分反应达平衡后,测得起始时混合气的密度是平衡时混合气密度的1.4倍,若此时容器的体积为2L,则该反应的平衡常数为______________(结果保留2位有效数字)。
Ⅲ.CO变换:500℃时,CO进一步与水反应生成CO2和H2。
Ⅳ.H2提纯:将CO2和H2分离得到H2的过程如示意图
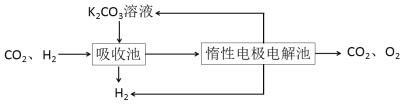
(4)吸收池中发生反应的离子方程式是____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于能源利用的说法中正确的是( )
A.贮氢材料在使用中,氢分子被吸收时,在合金表面解离变成氢原子,同时放出热量
B.使用化石燃料不会带来环境污染问题
C.对城市废弃物进行处理后焚烧,利用产生的热能供暖和发电
D.将氢气作为燃料使用的优点之一是成本低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,一定压强下的密闭容器中发生反应:aX(g)+bY(g)![]() cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
cZ(g)+dW(g),达平衡后,保持温度不变压强增大至原来的2倍,当再达到平衡时,W的浓度为原平衡状态的1.8倍,下列叙述正确是
A. 平衡正移 B. (a+b)>(c+d)
C. Z的体积分数变小 D. X的转化率变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 某温度下,蒸馏水中的[H+]=1.0×10—6mol·L—1,则该温度一定高于25℃
B. 25℃时,pH=13的氢氧化钡溶液中,由水电离出来的[H+]=1.0×10—13mol·L—1,此时由水电离出来的[OH—]![]() [H+]
[H+]
C. 25℃时,水中加入氢氧化钠固体,水的电离平衡逆向移动,水的离子积减小
D. 25℃时,0.1 mol·L—1的盐酸与0.1mol·L—1的NaOH溶液中,水的电离程度不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一种瓦斯分析仪(下图甲)能够在煤矿巷道中的甲烷达到一定浓度时,通过传感器显示出来。该瓦斯分析仪工作原理类似燃料电池的工作原理,其装置如下图乙所示,其中的固体电解质是Y2O3-Na2O,O2-可以在其中自由移动。下列有关叙述正确的的是( )

A. 瓦斯分析仪工作时,电池内电路中电子由电极b流向电极a
B. 电极a的反应式为:CH4+5O2-―8e-=CO32- +2H2O
C. 电极b是正极, O2-由电极a流向电极b
D. 当固体电解质中有1 mol O2-通过时,电子转移4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和钴是两种重要的过渡元素。
(1)钴位于元素周期表的第______族,其基态原子中未成对电子个数为________。
(2)[Fe(H2NCONH2)]6(NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为_________________________________,所含非金属元素的电负性由大到小的顺序是_____________________________。
(3)尿素[CO(NH2)2]分子中,碳原子为_______杂化,分子中σ键与π键的数目之比为_________。
(4)Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br]SO4和[Co(SO4)(NH3)5]Br。已知Co3+的配位数为6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物溶液中加入硝酸银溶液产生白色沉淀,在第二种配合物溶液中加入硝酸银溶液产生淡黄色沉淀。则第二种配合物的配体为__________。

(5)奥氏体是碳溶解在r-Fe中形成的一种间隙固溶体,无磁性,其晶胞为面心立方结构,如图所示,则该物质的化学式为____________。若晶体密度为d g·cm-3,则晶胞中最近的两个碳原子的距离为__________pm(阿伏加德罗常数的值用NA表示,写出简化后的计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识回答下列问题。
(1)已知Ksp(BaCO3) =2.6×l0-9,Ksp(BaSO4)=1.1×10-10。
①BaCO3在20 mL 0.01 mol·L-1Na2CO3溶液中的Ksp _________(填“大于”、“小于”或“等于”)其在20 mL 0.01 mol·L-1 BaCl2溶液中的Ksp
②现将浓度为2×10-4mol/LNa2CO3溶液与BaCl2溶液等体积混合,则生成BaCO3沉淀所需BaCl2溶液的最小浓度为_______mol/L。
③向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时,溶液中c(CO32—)/c(SO42—)=___________(保留三位有效数字)。
(2)已知25℃ 时,Ksp[AgCl]=1.8×10-10,现将足量氯化银分别放入:a.100mL蒸馏水中;b.100mL 0.2 mol/LAgNO3溶液中;c.100mL 0.1 mol/L氯化铝溶液中;d.100mL 0.1 mol/L盐酸溶液中。充分搅抖后,相同温度下银离子浓度由大到小的顺序是_______________。(填写序号);b中氯离子的浓度为__________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的叙述中,不正确的是( )
A.Cl2常用于自来水消毒B.SO2常用于漂白食品
C.SiO2常用于制造光导纤维D.含碘食盐可预防甲状腺肿大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com