
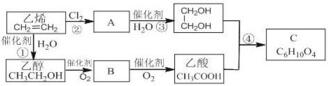
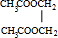 +2H2O.
+2H2O. 分析 乙烯与氯气发生加成反应生成A,A为ClCH2CH2Cl,在氢氧化钠水溶液、加入条件下发生水解反应生成乙二醇.乙烯与水发生加成反应生成乙醇,乙醇氧化生成B,B氧化生成乙酸,故B为CH3CHO.乙酸与乙二醇发生酯化反应生成C,由C的分子式C6H10O4可知,C为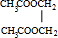 ,以此解答该题.
,以此解答该题.
解答 解:乙烯与氯气发生加成反应生成A,A为ClCH2CH2Cl,在氢氧化钠水溶液、加入条件下发生水解反应生成乙二醇.乙烯与水发生加成反应生成乙醇,乙醇氧化生成B,B氧化生成乙酸,故B为CH3CHO.乙酸与乙二醇发生酯化反应生成C,由C的分子式C6H10O4可知,C为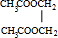 ,
,
(1)乙烯在催化剂条件下能够与水发生加成反应生成乙醇,故答案为:加成;
(2)由以上分析可知B为CH3CHO,故答案为:CH3CHO;
(3)乙酸含有的官能团为羧基,故答案为:羧基;
(4)反应②为乙醇催化氧化生成乙醛,反应方程式为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O,反应④是乙酸与乙二醇发生酯化反应生成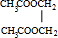 ,反应方程式为2CH3COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$
,反应方程式为2CH3COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$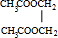 +2H2O,
+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{Cu}$2CH3CHO+2H2O;2CH3COOH+HOCH2CH2OH$→_{△}^{浓硫酸}$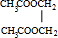 +2H2O.
+2H2O.
点评 本题考查有机物之间的转化关系,涉及烯烃、醇、醛、羧酸、卤代烃性质,考查官能团、有机反应类型、同分异构体、方程式书写等,掌握官能团的性质是解题的关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸具有吸水性,因而能使蔗糖炭化 | |
| B. | 浓硫酸在常温下不容易与铜片反应放出二氧化硫气体 | |
| C. | 浓硫酸是一种干燥剂,能够干燥氨气、氢气等气体 | |
| D. | 浓硫酸在常温下能够使铁、铝、锌等金属钝化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 |
| 开始沉淀的pH | 1.8 | 6.3 | 5.2 |
| 完全沉淀的pH | 3.0 | 8.3 | 6.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
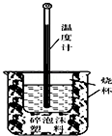 某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:
某学习小组的同学在实验室利用如图装置进行中和热的测定.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 葡萄糖属于糖类,能发生水解 | |
| B. | 甲烷是最简单的有机化合物 | |
| C. | 油脂有油和脂肪之分,但都属于脂 | |
| D. | 蛋白质、油脂、糖类是三大基本营养物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
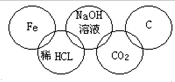 某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )
某同学在奥运五连环中填入了5种物质,相连环物质间能发生反应,不相连间不能发生反应.你认为在“五连环”物质的反应中,属于氧化还原反应的有几个,哪种基本反应类型没有涉及到( )| A. | 1个、复分解反应 | B. | 2个、分解反应 | C. | 3个、化合反应 | D. | 2个、置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
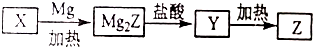
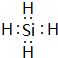 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com