
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.8 | 2.1 | 2.5 | 3.0 | 0.8 |
科目:高中化学 来源: 题型:阅读理解
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 520 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年福建省泉州一中高二下学期期中考试化学试卷(带解析) 题型:填空题
(11分)
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):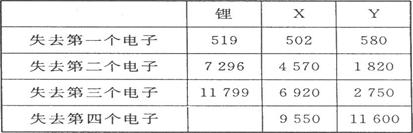
通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源:2013届福建省高二下学期期中考试化学试卷(解析版) 题型:填空题
(11分)
(1)、下表是一些短周期元素的气态原子失去核外不同电子所需的能量(kJ·mol-1):
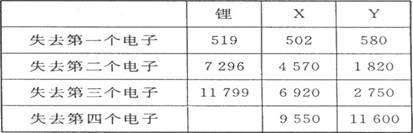
通过表中的数据分析为什么锂原子失去核外第二个电子时所需的能量要远远大于失去第一个电子所需的能量 ,
X在周期表中位置:第 期, 族,Y的最高正价为 。
(2)1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。电负性(用X表示)也是元素的一种重要性质,下表给出的是原子序数小于20的16种元素的电负性数值:
|
元素 |
H |
Li |
Be |
B |
C |
N |
O |
F |
|
电负性 |
2.1 |
1.0 |
1.5] |
2.0 |
2.5 |
3.0 |
3.5 |
4.0 |
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
1.7 |
2.1 |
2.3 |
3.0 |
0.8 |
请仔细分析,回答下列有关问题:
①、上表中电负性最小的元素是 (填元素符号),估计钙元素的电负性的取值范围:__________<X<__________。
②、经验规律告诉我们:当形成化学键的两原子相应元素的电负性差值大于1.7时,所形成 的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中形成的化学键的类型为
______________,其理由是 。
查看答案和解析>>
科目:高中化学 来源:2013届河北省高二下学期期中考试化学试卷(解析版) 题型:选择题
1932年美国化学家鲍林(L.Pauling)首先提出了电负性的概念。下表给出的是第三周期的七种元素和第四周期的钾元素的电负性的值。下列说法不正确的是( )
|
元素 |
Na |
Mg |
Al |
Si |
P |
S |
Cl |
K |
|
电负性 |
0.9 |
1.2 |
1.5 |
? |
2.1 |
2.3 |
3.0 |
0.8 |
A 钙元素的电负性的取值范围在0.8与1.2之间
B. 硫化钠的电子式为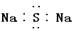
C 硅元素的电负性的取值范围 在1.5与2.1之间
D Al与S形成的化学键可能为共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com