
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH)4(绿色)、Cr2O72(橙红色)、CrO42(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+ 与 Al3+ 的化学性质相似,在Cr2(SO4)3 溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_________。
(2)CrO42 和 Cr2O72 在溶液中可相互转化。室温下,初始浓度为1. 0 mol·L1的Na2CrO4 溶液中c(Cr2O72) 随c(H+) 的变化如图所示。

①用离子方程式表示Na2CrO4溶液中的转化反应____________。
②由图可知,溶液酸性减小,CrO42 的平衡转化率__________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的逆反应的平衡常数为__________。
③升高温度,溶液中CrO42的平衡转化率减小,则该反应的ΔH____0(填“大于”“小于”或“等于”)。
(3)+6价铬的化合物毒性较大,常用NaHSO3将废液中的 Cr2O72 还原成 Cr3+,反应的离子方程式为______________。
【答案】 蓝紫色溶液变浅,同时有灰蓝色沉淀生成,然后沉淀逐渐溶解,生成绿色溶液 2CrO42- + 2H+ ![]() Cr2O72- + H2O 减小 1.0×10-14 小于 Cr2O72 -+ 3HSO3- + 5H+ = 2Cr3+ + 3SO42- + 4H2O
Cr2O72- + H2O 减小 1.0×10-14 小于 Cr2O72 -+ 3HSO3- + 5H+ = 2Cr3+ + 3SO42- + 4H2O
【解析】(1)Cr3+与Al3+的化学性质相似可知Cr2(SO4)3溶液中逐滴加入NaOH溶液,先生成Cr(OH)3灰蓝色沉淀,继续加入NaOH后沉淀溶解,生成绿色Cr(OH)4-;(2)①随着H+浓度的增大,CrO42-转化为Cr2O72-的离子反应式为:2CrO42-+2H+Cr2O72-+H2O;②溶液酸性减小,平衡2CrO42-+2H+Cr2O72-+H2O逆向进行,CrO42-的平衡转化率减小;A点Cr2O72-的浓度为0.25mol/L,则消耗的CrO42-的浓度为0.5mol/L,则溶液中的c(CrO42-)=1.0mol/L-0.25mol/L×2=0.5mol/L,H+浓度为1×10-7mol/L,此时该转化反应的平衡常数为 K=c(Cr2O72-) /c2(H+)c2(CrO42-) =0.25/0.52×(107)2=1.0×1014,因此逆反应的平衡常数为1.0×10-14;③升高温度,溶液中CrO42-的平衡转化率减小,平衡逆向移动,说明正方向放热,则该反应的△H<0;(3)利用NaHSO3的还原性将废液中的Cr2O72-还原成Cr3+,发生反应的离子方程式为:5H++Cr2O72-+3HSO3-=2Cr3++3SO42-+4H2O。


科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.离子键只存在于金属阳离子与酸根阴离子之间
B.两种非金属元素形成AB型化合物,它一定含共价键
C.物质中化学键破坏了,一定发生化学变化
D.化学键类型一定由元素类别决定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】取8 g某有机物A(相对分子质量为32),在氧气中完全燃烧,生成物中只有11 g CO2和9 g H2O,则A的分子式是 ,其化学名为 ,写出此物质在空气中燃烧的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是
A.纯铁比生铁更耐腐蚀
B.明矾水解形成胶体能吸附悬浮物,可用于净水
C.碳酸钠溶液呈碱性是因为其在水中电离出OH-
D.工业废水中的Cu2+和Hg2+可用Na2S或H2S除去
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
化学键 | N≡N | F—FZ§X§X§K] | N—F |
键能/ kJ·mol-1 | 941.7 | 154.8 | 283.0 |
下列说法中正确的是( )
A. 过程N2(g)![]() 2N(g)放出能量
2N(g)放出能量
B. 过程N(g)+3F(g)![]() NF3(g)放出能量
NF3(g)放出能量
C. 反应N2(g)+3F2(g)![]() 2NF3(g)的ΔH>0
2NF3(g)的ΔH>0
D. NF3吸收能量后如果没有化学键的断裂与生成,仍能可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中错误的是( )。
A.带相反电荷离子之间的相互吸引力称为离子键
B.金属元素与非金属元素化合时,不一定形成离子键
C.某元素的原子最外层只有一个电子,它跟卤素结合时所形成的化学键不一定是离子键
D.非金属原子间也可能形成离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期元素A、B、C、D、E的原子序数依次增大,基态A原子核外电子占据3个轨道,基态B原子核外电子占据3个能级且每个能级上电子数相等,C的双原子单质分子中σ键和π键数目之比为1:2,D的最高正化合价和最低负化合价之和等于4;基态E原子核外有6个未成对电子。
(1)基态E原子的核外电子排布式为______;基态D原子核外电子占据的能量最高的能级符号为_____________。
(2)A元素的各级电离能如下:
能级(I) | I1 | I2 | I3 | I4 | I5 |
电离能/kJ·mol-1 | 800.6 | 2427 | 3660 | 25026 | 32827 |
分析上表数据知,相邻两个电子的电离能中,I3和I4之间差异最大,其主要原因是__________。
(3)A、B、C元素的最高价氧化物对应的水化物酸性依次增强,其原因是________。
(4)氯元素与A、B、C元素组成的共价分子ACl3、BCl4、CCl3中,中心原子采用sp3杂化、立体构型为三角锥形的是_______(填分子式)。
(5)(DC)4为热色性固体,且有色温效应。低于-30℃时为淡黄色,室温下为橙黄色,高于100℃时为深红色。在淡黄色→橙黄色→深红色的转化中,破坏的作用力是____;在常压下,(DC)4高于130℃分解为相应的单质,这一变化中破坏的作用力是_______。在B、C、D的简单气态氢化物中,属于非极性分子的是______(填分子式,下同),常与Cu2+、Zn2+、Ag+等形成配离子的是_______________。
(6)A、C形成立方晶体,晶体结构类似金刚石,如图所示。已知:该晶体密度为ρg·㎝-3,NA代表阿伏伽德罗常数的值。
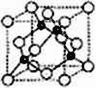
①该晶体的化学式为__________。
②在该晶体中,A与C形成共价键的键长(d)为_____pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,将2 mol SO2和1 mol O2充入一定容积的密闭容器中,在催化剂作用下发生如下反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
2SO3(g);ΔH=-197 kJ·mol-1,当达到化学平衡时,下列说法中正确的是
A. 生成SO3 2 mol B. 放出197 kJ热量 C. SO2和SO3共2 mol D. 含氧原子共8 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分离下列各组物质,采用的方法正确的是
A. 铝粉中混有铁粉:加氢氧化钠溶液过滤 B. 乙醇和水:分液
C. 氯化钠和氯化铵固体:加热 D. 苯和苯酚:加水后分液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com