
| 硝酸体积(mL) | 100 | 200 | 300 | 400 |
| 剩余固体(g) | 18.0 | 9.6 | 0 | 0 |
| 放出气体的体积(mL) | 2240 | 4480 | 6720 |
分析 (1)加入100mL硝酸时,金属有剩余,说明金属溶解生成二价离子且硝酸完全反应生成硝酸银和NO,n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,生成NO和消耗硝酸之间的关系式为2NO~~8HNO3,据此计算硝酸浓度;
(2)ρ=$\frac{cM}{1000w}$=$\frac{4×63}{1000×0.2}$=1.26g/cm3;
(3)实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4.48L-2.24L=2.24L,NO物质的量为0.1mol,
根据电子转移守恒可知,参加反应金属的物质的量为:$\frac{0.1mol×(5-2)}{2}$=0.15mol,参加反应金属的平均摩尔质量为 $\frac{8.4g}{0.15mol}$=56g/mol,故该过程只有Fe参加反应,故实验①、②只有Fe参与反应;
(4)100-200mL时,溶解金属质量=18.0g-9.6g=8.4g,金属有剩余,说明生成的金属阳离子是二价铁离子,增加n(NO)=$\frac{4.48L-2.24L}{22.4L/mol}$=0.1mol,根据转移电子守恒得n(金属)=$\frac{0.1mol×(5-2)}{2-0}$=0.15mol,金属平均摩尔质量=$\frac{8.4g}{0.15mol}$=56g/mol,所以溶解的是Fe;
200-300mL时,溶解金属质量=9.6g-0=9.6g,增加n(NO)=$\frac{6.72L-4.48L}{22.4L/mol}$=0.1mol,假设溶解的完全是铜,
根据转移电子守恒得n(金属)=$\frac{0.1mol×(5-2)}{2-0}$=0.15mol,金属平均摩尔质量=$\frac{9.6g}{0.15mol}$=64g/mol,所以溶解的完全是Cu;
(5)400mL该稀硝酸中含有硝酸的物质的量为:4mol/L×0.4L=1.6mol,根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O计算出铁完全反应生成硝酸铁消耗硝酸的物质的量,再计算出铜完全反应消耗硝酸的物质的量,根据计算结果判断硝酸过量情况,再计算出溶液中含有的硝酸根离子的物质的量;
(6)由(4)铜离子的物质的量为0.15mol,所以消耗0.15mol的亚铁离子转移电子数为0.15mol,生成一氧化氮的物质的量为:$\frac{0.15mol}{3}$=0.05mol,计算生成NO体积.
解答 解:(1)加入100mL硝酸时,金属有剩余,说明金属溶解生成二价离子且硝酸完全反应生成硝酸银和NO,n(NO)=加入100mL硝酸时,金属有剩余,说明金属溶解生成二价离子且硝酸完全反应生成硝酸银和NO,n(NO)=$\frac{2.24L}{22.4L/mol}$=0.1mol,生成NO和消耗硝酸之间的关系式为2NO----8HNO3,c(HNO3)=$\frac{n}{V}$=$\frac{\frac{0.1mol}{2}×8}{0.1L}$=4mol/L,故答案为:4;
(2)ρ=$\frac{cM}{1000w}$=$\frac{4×63}{1000×0.2}$=1.26g/cm3,故答案为:1.26;
(3)实验①②都有金属剩余,则溶液中不可能含有硝酸铁,溶液中金属离子为+2价,在实验①的基础上加入100mL硝酸,参加反应的金属的质量为18g-9.6g=8.4g,生成NO的体积为4.48L-2.24L=2.24L,NO物质的量为0.1mol,
根据电子转移守恒可知,参加反应金属的物质的量为:$\frac{0.1mol×(5-2)}{2}$=0.15mol,参加反应金属的平均摩尔质量为 $\frac{8.4g}{0.15mol}$=56g/mol,故该过程只有Fe参加反应,故实验①、②只有Fe参与反应;放出2240mL气体时,反应的离子方程式是:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O,当放出4480mL气体时,消耗金属的质量为8.4g×2=16.8g,故答案为:3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O; 16.8;
(4)100-200mL时,溶解金属质量=18.0g-9.6g=8.4g,金属有剩余,说明生成的金属阳离子是二价铁离子,增加n(NO)=$\frac{4.48L-2.24L}{22.4L/mol}$=0.1mol,根据转移电子守恒得n(金属)=$\frac{0.1mol×(5-2)}{2-0}$=0.15mol,金属平均摩尔质量=$\frac{8.4g}{0.15mol}$=56g/mol,所以溶解的是Fe;
200-300mL时,溶解金属质量=9.6g-0=9.6g,增加n(NO)=$\frac{6.72L-4.48L}{22.4L/mol}$=0.1mol,假设溶解的完全是铜,
根据转移电子守恒得n(金属)=$\frac{0.1mol×(5-2)}{2-0}$=0.15mol,金属平均摩尔质量=$\frac{9.6g}{0.15mol}$=64g/mol,所以溶解的完全是Cu,所以铁的物质的量为:$\frac{16.8}{56}$=0.3mol,而铜的物质的量为:$\frac{9.6}{64}$=0.15mol,所以铁和铜的物质的量比为2:1,故答案为:2:1;
(5)400mL该稀硝酸中含有硝酸的物质的量为4mol/L×0.4L=1.6mol,根据反应Fe+4HNO3=Fe(NO3)3+NO↑+2H2O可知,0.3mol铁完全反应消耗硝酸的物质的量为0.3mol×4=1.2mol,0.15mol铜完全反应消耗硝酸的物质的量为0.15mol×$\frac{8}{3}$=0.4mol,总共需要消耗1.6mol硝酸,说明加入400mL稀硝酸后恰好反应,硝酸和金属恰好反应生成硝酸铜、硝酸铁,所以溶液中硝酸根离子的物质的量为0.3mol×3+0.15mol×2=1.2mol,故答案为:1.2;
(6)由(4)铜离子的物质的量为0.15mol,所以消耗0.15mol的亚铁离子转移电子数为0.15mol,生成一氧化氮的物质的量为:$\frac{0.15mol}{3}$=0.05mol,放出气体的体积为:6720+0.05mol×22.4L/mol×1000mL/L=7840mL,故答案为:7840.
点评 本题考查混合物的有关计算,题目浓度较大、计算过程较复杂、计算量较大,为易错题目,根据表中数据判断各阶段发生的反应是解题关键,侧重对学生综合能力的考查.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝能与所有的酸和碱反应放出氢气 | |
| B. | 用酒精灯外焰加热铝箔,可以看到少量液滴悬而不落,说明铝的熔点比氧化铝高 | |
| C. | 铝合金质轻,强度大,耐腐蚀,可以用作门窗 | |
| D. | 氢氧化铝能溶于氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解AlCl3、FeCl3、CuCl2的混合溶液时阴极上依次析出Cu、Fe、Al | |
| B. | 可以用铝热反应来制取镁 | |
| C. | 铁在高温下与水蒸气反应生成Fe2O3和H2 | |
| D. | Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 金属Na、Mg、A1熔、沸点由高到低 | |
| B. | HC1、HBr、HI的还原性由弱到强 | |
| C. | H+、Li+、H-的半径由小到大 | |
| D. | 同浓度的硫酸钠、乙酸钠、碳酸钠溶液的碱性由强到弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
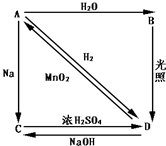 常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示
常温下,A是双原子分子气态单质,显黄绿色,M为71g/mol,B、C、D都是含A元素的化合物,转化关系如图所示查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯化钠溶液显中性,可用铝制容器贮存氯化钠溶液 | |
| B. | SO2具有漂白性,可使紫色石蕊试液褪为无色 | |
| C. | 丁达尔效应是区分胶体和溶液的一种常用物理方法 | |
| D. | 在实验室里,常用电解饱和食盐水的方法制取氯气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com