
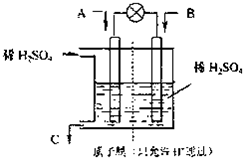
 CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.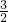 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ mol-1则表示液态甲醇燃烧热的热化学方程式为______.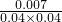 =4.375<13.3,平衡常数减小,则反应向逆反应方向移动,改变条件是升高温度,
=4.375<13.3,平衡常数减小,则反应向逆反应方向移动,改变条件是升高温度,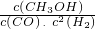 =
=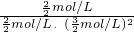 =0.44>0.27,即Qc>K,所以此时反应将向逆反应方向进行,
=0.44>0.27,即Qc>K,所以此时反应将向逆反应方向进行,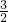 O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ/molⅡ
O2(g)═CO2(g)+2H2O(l)△H=-594.1kJ/molⅡ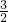 O2(g)=CO2(g)+2H2O(l)△H=(-594.1kJ/mol )-(+131.9kJ/mol )=-726 KJ/mol,
O2(g)=CO2(g)+2H2O(l)△H=(-594.1kJ/mol )-(+131.9kJ/mol )=-726 KJ/mol,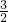 O2(g)=CO2(g)+2H2O(l)△H=-726 KJ/mol.
O2(g)=CO2(g)+2H2O(l)△H=-726 KJ/mol.

 星级口算天天练系列答案
星级口算天天练系列答案科目:高中化学 来源: 题型:
下列分子或离子在指定的分散系中能大量共存的一组是
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2013-2014学年四川省成都市高三第二次诊断考试理综化学试卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是( )
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br—
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
查看答案和解析>>
科目:高中化学 来源:2014届河南省高三上学期期中考试化学试卷(解析版) 题型:选择题
下列分子或离子在指定的分散系中能大量共存的一组是
A.纯碱溶液:NH4+、K+、NO3-、NH3·H2O
B.空气:C2H2、CO2、SO2、NO
C.氢氧化铁胶体:H+、K+、S2-、Br-
D.高锰酸钾溶液:H+、Na+、SO42-、H2O2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com