
| A. | 标况下,2.24L Cl2完全溶于水转移电子数为0.1NA | |
| B. | 1L 0.1mol•L-1 NaClO溶液中,ClO-的数目为NA | |
| C. | 2gNO2和44gN2O4的混合气体所含原子数为3NA | |
| D. | 18gD2O所含的电子数为10NA |
分析 A、氯气与水的反应为可逆反应;
B、ClO-是弱酸根,在溶液中会水解;
C、NO2和N2O4的最简式均为NO2;
D、重水的摩尔质量为20g/mol.
解答 解:A、氯气与水的反应为可逆反应,不能进行彻底,故转移的电子数小于0.1NA个,故A错误;
B、ClO-是弱酸根,在溶液中会水解,故溶液中的次氯酸跟的个数小于NA个,故B错误;
C、NO2和N2O4的最简式均为NO2,故46g混合气体中NO2的物质的量n=$\frac{46g}{46g/mol}$=1mol,故含有3mol原子,即3NA个,故C正确;
D、重水的摩尔质量为20g/mol,故18g重水的物质的量n=$\frac{18g}{20g/mol}$=0.9mol,而1mol重水含10mol电子,故0.9mol重水中含9mol电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
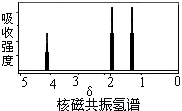
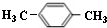
| A. | CH3COOCH2CH3 | B. | CH3CH=CHCH3 | C. | CH3CH2CH3 | D. | CH3CHOHCH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将LiCoO2改写成为氧化物的形式为Li2O•Co2O3 | |
| B. | 该电池的电解液必须使用有机溶剂主要是由于有机溶剂有良好的导电性 | |
| C. | Li是3号元素,是最轻的金属之一,这类电池质能比高 | |
| D. | 在电池充放电时,Li+在两个电极之间往返嵌入和脱嵌.该电池的充放电反应方程式为:LiCoO2+6C$?_{放电}^{充电}$Li1-xCoO2+LixC6 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
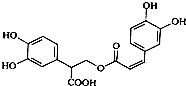
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和含6mol H2发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
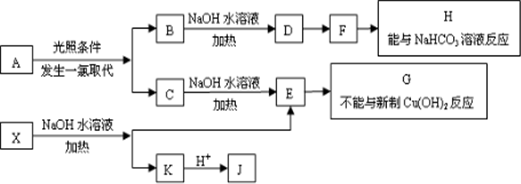
 .
.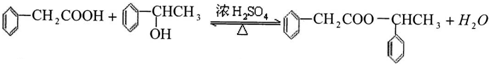 ;该反应类型是酯化反应(或取代反应).
;该反应类型是酯化反应(或取代反应).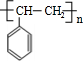 .
.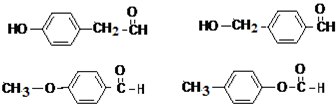 任意一种.
任意一种.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
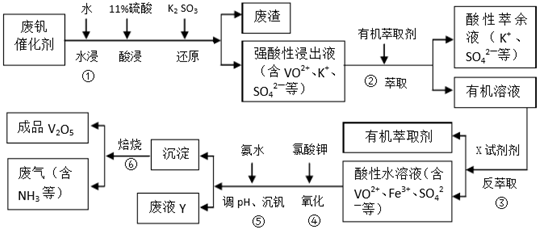
| pH | 1.3 | 1.4 | 1.5 | 1.6 | 1.7 | 1.8 | 1.9 | 2.0 | 2.1 |
| 钒沉淀率/% | 88.1 | 94.8 | 96.5 | 98.0 | 98.8 | 98.6 | 96.4 | 93.1 | 89.3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com