
| A. | 2ml0.3mol/L的硅酸钠溶液中滴入稀盐酸所制得的硅酸胶体中胶粒的数目为0.0006NA | |
| B. | 常温下,1LpH=2的H2S溶液中H+的数目为0.01NA | |
| C. | 1mol铁粉与22.4L(标准状况)氯气充分反应,转移的电子数是3NA | |
| D. | 常温常压下,2.8gC4H8中有1.2NA的共价键 |
分析 A.胶粒是一定数目粒子的集合体;
B.pH=2,则c(H+)=0.01mol/L,利用n=cV、N=n×NA来计算;
C.氯气与铁反应生成氯化铁,标况下22.4L氯气的物质的量为1mol,完全反应得到2mol电子;
D.C4H8最简式为CH2,平均含有3个共价键.
解答 解:A.胶粒是一定数目粒子的集合体,2ml0.3mol/L的硅酸钠溶液中滴入稀盐酸所制得的硅酸胶体中胶粒的数目小于0.0006NA,故A错误;
B.pH=2,则c(H+)=0.01mol/L,H+的数目为0.01mol/L×1L×NAmol-1=0.01NA,故B正确;
C.氯气与铁反应生成氯化铁,标况下22.4L氯气的物质的量为1mol,完全反应得到2mol电子,故C错误;
D.常温常压下,2.8gC4H8含CH2物质的量$\frac{2.8g}{14g/mol}$=0.2mol,含有有0.6NA的共价键,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,注意溶液pH计算公式及含义.


 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 镁、铝在常温下都能被氧气氧化 | |
| B. | 将氯化铝和硫酸铝溶液蒸干灼烧后均得到氧化铝 | |
| C. | Na2O2与水反应,红热的铁与水蒸气反应均能生成碱 | |
| D. | Fe(OH)3不溶于水不能通过化合反应直接得到 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
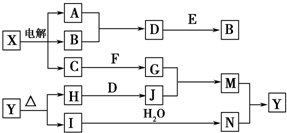 框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.
框图中的字母分别代表一种常见的物质或其溶液,相互之间的转化关系如图所示(部分产物及反应条件已略去).已知A、B为气态单质,F是地壳中含量最多的金属元素的单质;E、H、I为氧化物,E为黑色固体,I为红棕色气体;M为红褐色沉淀.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠和冷水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 金属铝溶于氢氧化钠溶液中:Al+2OH-═Al${O}_{2}^{-}$+H2↑ | |
| C. | 金属铝溶于盐酸中:2Al+6H+═2Al3++3H2↑ | |
| D. | Fe(OH)3跟盐酸反应:OH-+H+═H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
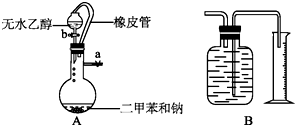 为了测定乙醇的结构式,有人设计了无水酒精与钠反应的实验装置和测定氢气体积的测量装置.
为了测定乙醇的结构式,有人设计了无水酒精与钠反应的实验装置和测定氢气体积的测量装置.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CO2的摩尔质量为44g | |
| B. | 1 mol N2的质量是14g | |
| C. | 标准状况下,1 mol CO2所占的体积约是22.4L | |
| D. | 将40 g NaOH溶于1 L水中,所得溶液中NaOH的物质的量浓度为1 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
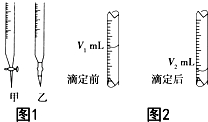 现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:
现用物质的量浓度为a mol•L-1的标准NaOH溶液去滴定V mL盐酸的物质的量浓度,请填写下列空白:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 操作 | 现象 | 结论 |
| A | 某溶液加入K3[Fe(CN)6]溶液 | 黑色沉淀生成 | 证明原溶液中存在Fe2+ |
| B | 某溶液加入HNO3、BaCl2混合液 | 产生白色沉淀 | 该溶液一定含有SO42- |
| C | 将水蒸气通过灼热的铁粉 | 粉末无变化 | 铁与水蒸汽高温下不反应 |
| D | 将一小块Na放入无水乙醇中 | 产生气泡 | Na能置换出醇羟基中的氢 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com