
| 酸的化学式 电离常数K | 氢硫酸 H2S | 亚硫酸 H2SO3 | 铬酸 H2CrO4 | 氰酸 HCN |
| K1 | 9.1×10-8 | 1.5×10-2 | 1.8×10-1 | 5.0×10-10 |
| K2 | 1.1×10-12 | 1.0×10-7 | 3.2×10-7 |
分析 (1)铬酸第二步电离方程式为HCrO4-=CrO42-+H+,据电离方程式书写平衡常数表达式;
(2)CN-的水解平衡常数与HCN的电离平衡常数的乘机等于水的离子积常数,据此分析;
(3)弱酸的酸性越弱,其水解程度越大;
(4)氢硫酸第一步电离程度大于第二步电离;
(5)H2SO3第一步电离产生的氢离子会抑制第二步电离;
(6)根据Ksp(BaCrO4)、Ksp(Ag2CrO4)计算生成BaCrO4、Ag2CrO4沉淀时CrO42-的浓度,比较大小后确定谁先沉淀.
解答 解:(1)铬酸第二步电离方程式为HCrO4-=CrO42-+H+,铬酸的第二步电离的K2=$\frac{[Cr{{O}_{4}}^{-}]•[{H}^{+}]}{[HCr{{O}_{4}}^{-}]}$,故答案为:$\frac{[Cr{{O}_{4}}^{-}]•[{H}^{+}]}{[HCr{{O}_{4}}^{-}]}$;
(2)CN-的水解平衡常数与HCN的电离平衡常数的乘机等于水的离子积常数,常温下,KCN的水解常数Kh=$\frac{{K}_{W}}{{K}_{a}}$=$\frac{1.0×1{0}^{-14}}{5.0×1{0}^{-10}}$=2.0×10-5,故答案为:2.0×10-5;
(3)据电离平衡常数可知,铬酸、亚硫酸、氢硫酸的第二步电离平衡常数依次减小,其对应酸根离子的水解程度依次增大,水解程度越大水的电离程度越大,
故答案为:K2S;
(4)氢硫酸是二元弱酸,分步电离,第二步电离程度小于第一步,所以离子浓度由大到小的顺序为H+>HS->S2+>OH-,故答案为:H+>HS->S2+>OH-;
(5)H2SO3第一步电离产生的氢离子会抑制第二步电离,所以H2SO3第二步电离常数小于第一步电离常数,故答案为:H2SO3第一步电离产生的氢离子会抑制第二步电离;
(6)Ag2CrO4开始沉淀时所需CrO42-浓度c(CrO42-)=$\frac{{K}_{sp}(A{g}_{2}Cr{O}_{4})}{[A{g}^{+}]^{2}}$=$\frac{1.12×1{0}^{-12}}{0.00{1}^{2}}$=1.12×10-6mol/L,
BaCrO4饱和所需CrO42-浓度c(CrO42-)=$\frac{{K}_{sp}(BaCr{O}_{4})}{[B{a}^{2+}]}$=$\frac{1.17×1{0}^{-10}}{0.001}$mol/L=1.17×10-7mol/L,
所以Ba2+先沉淀.
故答案为:BaCrO4.
点评 本题考查了电离平衡常数表达式书写、水解平衡常数计算、盐类水解、弱电解质的电离以及沉淀的溶度积,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 标准状况下2.24LO2 | B. | 含NA个氢原子的H2 | ||
| C. | 44gCO2 | D. | 含3.01×1023个分子的CH4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Fe3+、Br-、NO3- | B. | Fe2+、H+、NO3-、K+ | ||
| C. | Fe3+、Br-、NO3-、Cl- | D. | Fe2+、Br-、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ③①②④ | C. | ④③②① | D. | ③②①④ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
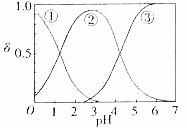 草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.
草酸、草酸盐在工业生产上用途非常广泛,H2C2O4水溶液中H2C2O4、HC2O4和C2O${\;}_{4}^{2-}$三种形态的粒子的分布分数δ随溶液pH变化的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 30min时降低温度,40min时升高温度 | |
| B. | 前8min A的平均反应速率为0.17mol/(L•min) | |
| C. | 反应方程式中的x=1,正反应为吸热反应 | |
| D. | 20min~40min间该反应的平衡常数均为4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 0.3 mol•L-1 Na2SO4溶液中含有Na+和SO${\;}_{4}^{2-}$总物质的量为0.9 mol | |
| B. | 50mL 1 mol•L-1的KCl溶液和100mL 0.5 mol•L-1MgCl2溶液中,Cl-的物质的量浓度相等 | |
| C. | 用1 L水吸收22.4 L氨气所得氨水的浓度是1 mol•L-1 | |
| D. | 10℃时0.35 mol•L-1的KCl饱和溶液100 mL,蒸发掉5 g水,再冷却到10℃时,它的物质的量浓度仍为0.35 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com