
已知某饱和溶液的①体积,②密度,③溶质和溶剂的质量比,④溶质的摩尔质量,要根据溶质的溶解度计算该溶液的物质的量浓度,上述条件中必不可少的是 ( )
A.②④ B.①④ C.①②③ D.①②③④
科目:高中化学 来源: 题型:阅读理解
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| X | 496 | 4562 | 6912 | 9543 |
| Y | 738 | 1451 | 7733 | 10540 |
| Z | 578 | 1817 | 2745 | 11578 |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

| 22.625cV |
| m |
| 22.625cV |
| m |
查看答案和解析>>
科目:高中化学 来源: 题型:
(10分)前四周期元素X、Y、Z、M、N原子序数依次增大,其中有两种是金属元素,X单质是密度最小的物质,Y原子最外层电子数是次外层的两倍,Z单质是大气中的一种气体,豆科植物常温下能将之转化为化合物。M元素的p电子总数比s电子总数多1,N是一种生命元素,人体缺少该元素会发生贫血,使人脸色萎黄。
请根据上述信息,回答下列问题:
(1)写出M原子基态电子排布式 。
(2)直线型分子Y2Z2中所有原子都达到8电子稳定结构,其中δ键、![]() 键之比是 。
键之比是 。
(3)上述五种元素能形成的晶体类型有 (填编号)。
①原子晶体②分子晶体③离子晶体④金属晶体
(4)已知:298 K时固体M在氧气中燃烧生成1 mol M203固体时,放出热量1676.2 kJ;固
体N在氧气中燃烧生成1 mol N304固体时,放出热量1118.4 kJ。请写出298 K时,由M
单质与Z304反应的热化学方程式:
(5)在沸水中加入N的某高价盐饱和溶液可以得到一种红褐色的液体,向该液体中逐滴加入含Z的最高价氧化物的水化物溶液直至过量的过程中发生的现象是____ 。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年天津市河东区高三第二次模拟考试理综化学试卷(解析版) 题型:填空题
某化学兴趣小组同学展开对漂白剂亚氯酸钠(NaClO2)的研究。
实验I:制取NaClO2晶体
己知:NaClO2饱和溶液在温度低于38℃时析出品体是NaClO2·3H2O,高于38℃时析出晶体是NaClO2,高于60℃时NaClO2分解成NaClO3和NaCl。利用下图所示装置进行实验。

(1)装置③的作用是
装置①的作用是
(2)装置②中产生ClO2的还原剂是
装置④中制备ClO2的化学方程式为
(3)从装置④反应后的溶液获得NaClO2晶体的操作步骤为:
①减压,55℃蒸发结晶:②趁热过滤;③ ;④低于60℃干燥,得到成品。
实验Ⅱ:测定某亚氯酸钠样品的纯度。
设计如下实验方案,并进行实验:
①准确称取所得亚氯酸钠样品小打烧杯中,加入适量蒸馏水和过量的碘化钾晶体,再滴入适量的稀硫酸,充分反应(已知:ClO2-+4I-+4H+=2H2O+2I2+Cl-)。将所得混合液配成250mL待测溶液。
②移取25.00mL待测溶液于锥形瓶中,加几滴淀粉溶液,用c mol·L-1 Na2S2O3标准液滴定,至滴定终点。重复2次,测得平均值为V mL(已知:I2+2S2O32-=2I-+S4O62-)。
(4)达到滴定终点时的现象为
(5)该样品中NaClO2的质量分数为 (用含m、c、V的代数式表示)。
(6)在滴定操作正确无误的情况下,此实验测得结果偏高,原因用离子方程式表示为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
名称 | 分子式 | 颜色、状态 | 溶解性(g) | 熔点(℃) | 密度(g/cm3) |
乙二酸 | H | 无色 | 8.6(20℃) | 189.5 | 1.900 |
二水合乙二酸 | H | 无色晶体 | —— | 101.5 | 1.650 |
某化学小组同学为r研究草酸(乙二酸的结构HOOC—COOH)的化学性质,进行以下实验。
(1)该小组同学向盛有5 mL乙二酸饱和溶液的试管中滴入3滴硫酸酸化的0.5%(质量分数)的KMnO4溶液,振荡,观察到现象为_____________;由此可推知乙二酸具有___________(填“氧化性”或“还原性”);菠菜中铁元素的主要存在价态可能是___________。
(2)已知草酸分解的化学方程式为H![]() H2O+CO2↑+CO↑。
H2O+CO2↑+CO↑。
该小组同学为了验证草酸受热分解的产物,设计了如图所示装置的实验。
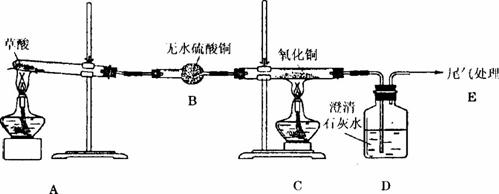
实验前,有同学提出用草酸品体进行实验,遭到大家的反对,其原因是____________________ ____________________;有同学提出这个实验不能检验二氧化碳气体,还需在B、C之间加入4个D装置,依次加入的试剂是___________、___________、_____________和浓硫酸,其中第3个D装置的作用是_______________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com