
【题目】下列分子式能表示的物质只有一种的是( )
A.C5H10
B.CH4O
C.C7H8O
D.C2H4Cl2
科目:高中化学 来源: 题型:
【题目】25℃,101k Pa时,已知下列可逆反应的焓变和化学平衡常数分别为:
①A(g)+2B(g)2C(g)+2D(l)△H1=﹣250.kJmol﹣1 K1=0.2
②E(s)+B(g)C(g)△H2=﹣310kJmol﹣1K2=2
③F(g)+ ![]() B(g)D(l)△H3=﹣200kJmol﹣1K3=0.8
B(g)D(l)△H3=﹣200kJmol﹣1K3=0.8
(1)写出反应 ①的平衡常数表达式K1= , 升高反应①的温度,反应①的平衡常数 , 增大压强,反应①的平衡常数(填“增大”或“减小”或“不变”)
(2)反应2F(g)+B(g)2D(l)△H= , 反应②的逆反应的平衡常数K4=
(3)反应2E(s)+2F(g)+B(g)A(g)的△H= , K= .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,反应:2A(g)B(g)+C(g)的平衡常数为1,在容积为2L的密闭容器中加入A(g),20s时测得各组分的物质的量如下表:下列说法正确的是( )
物质 | A(g) | B(g) | C(g) |
物质的量/mol | 1.2 | 0.6 | 0.6 |
A.反应前20 s内的平均反应速率为v(A)=0.6 molL﹣1s﹣1
B.20 s时,正反应速率大于逆反应速率
C.达到平衡时,A(g)的转化率为100%
D.若升高温度平衡常数变为2,则反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示铁与不同浓度硝酸反应时,各种还原产物的相对含量与硝酸溶液浓度的关系,则下列说法不正确的是( )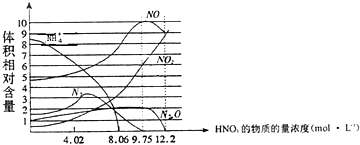
A.一般来说,硝酸与铁反应的还原产物不是单一的
B.用一定量的铁粉与大量的9.75molL﹣1HNO3溶液反应得到标态下气体2.24L,则参加反应的硝酸的物质的量为0.1mol.
C.硝酸的浓度越大,其还原产物中价态越高的成份越多
D.当硝酸浓度为9.75molL﹣1时还原产物是NO、NO2、N2O,且其物质的量之比为5:3:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝是重要的金属材料,铝土矿(主要成分是Al2O3和少量的SiO2、Fe2O3杂质)是工业上制取铝的原料。实验室模拟工业上以铝土矿为原料制取Al2(SO4)3和铵明矾晶体[NH4Al(SO4)2·12H2O]的工艺流程如图所示:
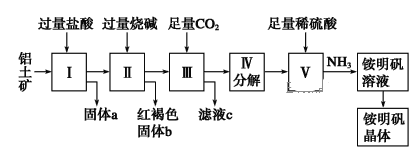
请回答下列问题:
(1)固体a的化学式为________。
(2)写出Ⅱ中加过量的烧碱涉及到的反应离子方程式______________、_____________;Ⅲ中通入足量CO2气体发生反应的离子方程式为_________________。
(3)由Ⅲ中得到滤液c的实验操作为__________,从铵明矾溶液中获得铵明矾晶体的实验操作依次为(填操作名称)________、冷却结晶、过滤洗涤。
(4)滤液c显________性,日常生活中常用其溶质来________________(任写一点);
(5)若同时制取铵明矾和硫酸铝,通过控制硫酸的用量调节两种产品的产量。若欲使制得的铵明矾和硫酸铝的物质的量之比为1∶1,则投料时铝土矿中的Al2O3和H2SO4的物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2 , 发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①能说明该反应已达平衡状态的是(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂.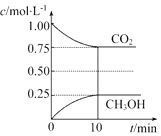
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锌是一种过渡金属,外观呈现银白色,在现代工业中对于电池制造上有不可磨灭的地位.现代炼锌的方法可分为火法和湿法两大类.硫酸铅是生产锌的副产品.
(1)火法炼锌是将闪锌矿(主要含ZnS)通过浮选、焙烧使它转化为氧化锌,再把氧化锌和焦炭混合,在鼓风炉中加热至1473﹣1573K,使锌蒸馏出来.将闪锌矿焙烧使它转化为氧化锌的主要化学反应方程式为 .
(2)某含锌矿的主要成分为ZnS(还含少量FeS等其他成分),以其为原料冶炼锌的工艺流程如图所示: 
回答下列问题:
①焙烧过程中产生的含尘烟气可净化制酸,该酸可用于后续的操作.
②浸出液“净化”过程中加入的主要物质为锌粉,其作用是 .
③改进的锌冶炼工艺,采用了“氧压酸浸”的全湿法流程,既省略了易导致空气污染的焙烧过程,又可获得一种有工业价值的非金属单质.“氧压酸浸”中发生的主要反应的离子方程式为
(3)工业冶炼锌的过程中,会产生铅浮渣(主要成分是PbO、Pb,还含有少量Ag、Zn、CaO和其他不溶于硝酸的杂质),某科研小组研究利用铅浮渣生产硫酸铅的流程如下: 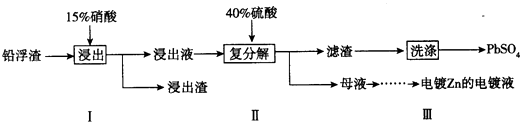
已知:25℃时,Ksp(CaSO4)=4.9×10﹣5 , KSP(PbSO4)=1.6×10﹣8 .
①已知步骤Ⅰ有NO气体产生,浸出液中含量最多的阳离子是Pb2+ . 写出Pb参加反应的化学方程式
②步骤Ⅰ需控制Pb的用量并使Pb稍有剩余,目的是 , 产品PbSO4还需用Pb(NO3)2溶液多次洗涤,目的是 .
③母液中可循环利用的溶质的化学式是(填一种物质);母液经过处理可得电镀Zn时电解质溶液,在铁棒上镀锌时,阳极材料为 .
(4)银锌电池是一种常见电池,电池的总反应式为:Ag2O+Zn+H2O=2Ag+Zn(OH)2 , 电解质溶液为KOH溶液,电池工作时正极的电极式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的2L固定容积的密闭容器中,通入2mol CO2和3mol H2 , 发生的反应为CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣akJmol﹣1(a>0),测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示.
①能说明该反应已达平衡状态的是(填编号).
A.单位时间内每消耗1.2mol H2 , 同时生成0.4mol H2O
B.CO2的体积分数在混合气体中保持不变
C.混合气体的平均相对分子质量不随时间的变化而变化
D.该体系中H2O与CH3OH的物质的量浓度之比为1:1,且保持不变
②若要使K=1,则改变的条件可以是(填选项).
A.增大压强 B.减小压强 C.升高温度 D.降低温度 E.加入催化剂.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com