
| A.合成氨生产中将NH3液化分离,可加快正反应速率,提高N2、H2的转化率 |
| B.联合制碱法是将二氧化碳和氨气通入饱和氯化钠溶液中,制得碳酸氢钠,再在高温下灼烧,转化为碳酸钠。 |
| C.硫酸工业中,在接触室安装热交换器是为了利用SO3转化为H2SO4时放出的热量 |
| D.电解饱和食盐水制烧碱采用离子交换膜法,可防止阴极室产生的C12进入阳极室 |


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
  压强 压强SO2的 转化率 温度 | 1×105 Pa | 5×105 Pa | 10×105 Pa | 50×105 Pa | 100×105 Pa |
| 450 ℃ | 97.5% | 98.9% | 99.2% | 99.6% | 99.7% |
| 550 ℃ | 85.6% | 92.9% | 94.9% | 97.7% | 98.3% |
 的空气是为了________。
的空气是为了________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
|
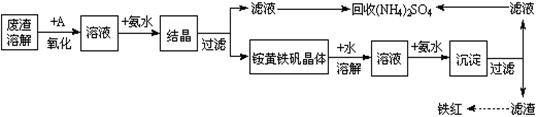
| A.氨水 | B.氢氧化钠 | C.盐酸 | D.硫酸 |
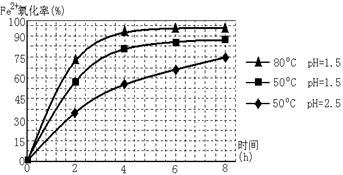
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| A.研制乙醇汽油(汽油中添加一定比例乙醇)技术,不能降低机动车尾气中有害气体排放 |
| B.工业上用石灰乳对煤燃烧后形成的烟气进行脱硫,最终能制得石膏 |
C.为了有效的发展清洁能源,采用电解水的方法大 量制备H2 量制备H2 |
| D.世博停车场安装催化光解设施,可将汽车尾气中CO和NOx反应生成无毒气体 |

 的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
的流程图。写出下图中①②的化学式:① ,② ,吸收塔中发生的化学反应方程式为 。
 4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的
4 SiHCl3(g)。达平衡后,H2与SiHCl3物质的量浓度分别为0.140mol/L和0.020mol/L,若H2全部来源于氯碱工业,理论上需消耗纯NaCl的 质量为 kg。
质量为 kg。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.明矾净水与液氯净水的原理相同 |
| B.镀层破损后,镀铜铁板比镀锌铁板更耐腐蚀 |
| C.必要时向空中播撒碘化银微粒,可达到人工降雨的目的 |
| D.碳酸钠可用于焙制糕点,也可用于治疗胃酸过多症 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
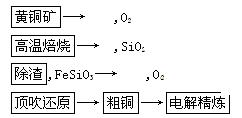
 到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。
到了NO和NO2的混合气体8.736L,与3.304LO2混合后,得到的混合气体恰好被水完全吸收。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
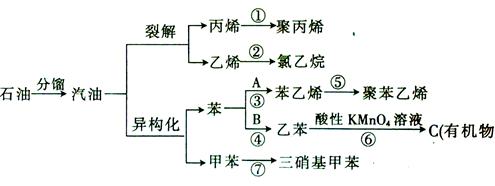
 ____________________________________________。
____________________________________________。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.碘(海带) | B.溴(海水晒盐后的余液) |
| C.乙烯(乙醇) | D.顺丁橡胶(石油裂解气) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com