
| A. | 用纯碱制烧碱 2KOH+Na2CO3=K2CO3+2NaOH 复分解反应 | |
| B. | 我国古代的“湿法炼铜”:2Fe+3CuSO4=3Cu+Fe2(SO4)3置换反应 | |
| C. | 用天然气作燃料 CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O 氧化反应 | |
| D. | 证明金属镁的活动性比铁强:3Mg+2Fe(OH)3=3Mg(OH)2+2Fe 置换反应 |
分析 A.化合物与化合物反应生成两种新化合物的反应为复分解反应,但KOH、Na2CO3不反应;
B.发生置换反应生成硫酸亚铁、Cu;
C.甲烷燃烧反应为氧化反应;
D.Fe(OH)3不溶于水,与Mg不反应.
解答 解:A.化合物与化合物反应生成两种新化合物的反应为复分解反应,但KOH、Na2CO3不反应,应利用纯碱与氢氧化钙反应,故A错误;
B.发生置换反应生成硫酸亚铁、Cu,反应为Fe+CuSO4=Cu+FeSO4,故B错误;
C.用天然气作燃料,发生CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,为氧化反应,故C正确;
D.Fe(OH)3不溶于水,与Mg不反应,不能说明金属的活泼性,故D错误;
故选C.
点评 本题考查氧化还原反应,为高频考点,把握物质的性质、发生的反应、反应分类为解答的关键,侧重分析与应用能力的考查,注意物质的性质及变化,题目难度不大.


科目:高中化学 来源: 题型:解答题
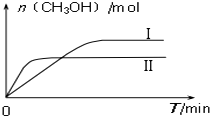 研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.
研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义.| 容 器 | 甲 | 乙 |
| 反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 第n周期的最后一种金属元素处在第n主族(n>1) | |
| B. | m=1与m=7的元素单质相互化合时,都能形成离子化合物 | |
| C. | 第n周期有8-n种非金属元素(n>1,包括稀有气体元素) | |
| D. | m-n=5的主族元素存在本周期最强的对应含氧酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 少量碳酸钙固体放在广口瓶中 | |
| B. | 少量浓硝酸放在棕色细口瓶中 | |
| C. | 少量金属钠保存在煤油中 | |
| D. | 少量氢氧化钠溶液保存在带玻璃塞的试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷结构的比例模型: | B. | 羟基的电子式: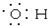 | ||
| C. | 羧基的结构简式: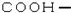 | D. | 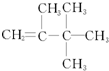 的名称:2,3,3-三甲基-1-丁烯 的名称:2,3,3-三甲基-1-丁烯 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com