
【题目】下列说法正确的是( )
①金属和非金属化合形成离子键
②离子键是阳离子,阴离子的相互吸引
③两个非金属原子间不可能形成离子键
④非金属原子间不可能形成离子键
⑤离子化合物可能含有共价键
⑥共价化合物中可能有离子键
A. ![]() B.
B. ![]() C. ③ ⑤D.
C. ③ ⑤D. ![]()
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。
a | b | c | |||||||||||||||
e | f | ||||||||||||||||
试回答下列问题:
(1)写出元素e的基态原子电子排布式________________,其未成对电子数为________。
(2)c在空气中燃烧产物的分子构型为_____,中心原子的杂化形式为______杂化。c能形成一种八元环状形同王冠的单质分子,原子的杂化形式为______杂化。
(3)b单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
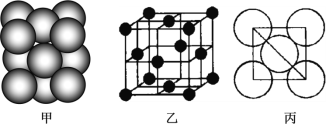
若已知b的原子半径为d厘米,NA代表阿伏加德罗常数,b的相对原子质量为M,请回答:
①晶胞中b原子的配位数为_____,表示原子空间占有率的代数式为_____________。
②该晶体的密度为_____________g/cm3(用含有关字母的代数式表示)。a、f中,与单质b晶体中原子的堆积方式相同的是__________(填元素符号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1996年诺贝尔化学奖授于斯莫利等三位化学家,以表彰他们发现富勒烯(C60)开辟了化学研究的新领域。后来,人们又发现了一种含碳量极高的链式炔烃──棒碳,它是分子中含300~500个碳原子的新物质,其分子中只含有交替连接的单键和叁键。对于C60与棒碳,下列说法正确的是
A.C60与棒碳中所有的化学键都是非极性共价键
B.棒碳不能使溴水褪色
C.C60在一定条件下可能与CuO发生置换反应
D.棒碳与乙炔互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)以下列出的是一些原子的2p能级和3d能级中电子排布的情况.试判断,违反了泡利原理的是_____,违反了洪特规则的是______。
![]()
(2)某元素的激发态(不稳定状态)原子的电子排布式为1s22s22p63s13p33d2,则该元素基态原子的电子排布式为________;其最高价氧化物对应水化物的化学式是________。
(3)用符号“>”“<”或“=”表示下列各项关系。
①第一电离能:Na________Mg,Mg________Ca。
②电负性:O________F,F________Cl。
③能量高低:ns________(n+1)s,ns________np。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M是一种重要材料的中间体,结构简式为:![]() 。合成M的一种途径如下:
。合成M的一种途径如下:
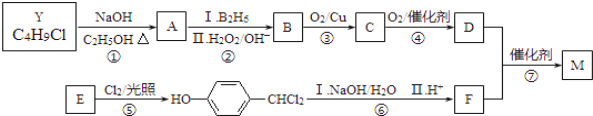
A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去.
已知:①Y的核磁共振氢谱只有1种峰;
②RCH=CH2 ![]() RCH2CH2OH;
RCH2CH2OH;
③两个羟基连接在同一个碳原子上不稳定,易脱水: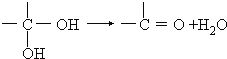
请回答下列问题:
(1)Y的结构简式是________,D的官能团名为________。
(2)步骤①的化学反应方程式是________。
(3)步骤⑤的反应类型是________。
(4)写出步骤⑥中第Ⅰ步化学反应方程式是________。
(5)下列说法不正确的是________。
a.A和E都能发生氧化反应 b.1molB完全燃烧需6mol O2
c.C能与新制氢氧化铜悬浊液反应 d.1molF最多能与3mol H2反应
(6)M经催化氧化得到X(C11H12O4),X的同分异构体中同时满足下列条件的结构简式为________。
a.苯环上只有两个取代基,苯环上的一氯代物有2种
b.水解只生成芳香醇和二元酸,且二元酸的核磁共振氢谱只有2种峰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物虽然种类繁多,但其命名是有规则的。下列有机物的命名正确的是( )
A. ![]() 1,4一二甲基丁烷 B.
1,4一二甲基丁烷 B. ![]() 3-甲基丁烯
3-甲基丁烯
C. HOOC-CH2-COOH丙二酸 D. CH2Cl-CH2Cl二氯乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁,在形成晶体时会结晶一定量的水;在工农业生产中具有重要用途,如照相的显影剂,生产磷酸铁锂电池的原料等。
已知:①草酸亚铁不溶于水,可溶于酸;②Fe(SCN)63-+3C2O42-=Fe(C2O4)33-+6SCN-。
回答下列问题:
Ⅰ.甲同学检查药品发现该晶体显浅黄色,认为晶体不纯,可能是因为部分的铁被氧化。为验证自己的猜想,进行实验验证。取少量的晶体样品溶于稀硫酸,滴加KSCN溶液,溶液无明显变化。由此认为晶体中不存在+3价的铁。你认为_______(填“正确”或“不正确”),理由是___________________________________。
Ⅱ.乙同学为测定草酸亚铁晶体FeC2O4﹒xH2O中的结晶水含量,利用如下装置:
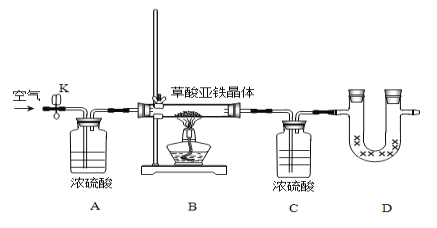
①做实验前首先要_____________________________;
②称取一定质量的晶体,装好药品,开始实验接下来的实验步骤依次为____________________,重复实验直至B中恒重。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.关闭K d.打开K,缓缓通入空气 e.冷却至室温 f.称量
Ⅲ.丙同学用滴定的方法也可以测定草酸亚铁晶体中结晶水的含量。取a克草酸亚铁晶体溶入稀硫酸,再把所得溶液稀释成500mL,取出50mL放入锥形瓶,向其中逐滴滴入未知浓度的酸性KMnO4溶液,振荡,发现溶液颜色逐渐变为棕黄色,且有气泡冒出,当溶液颜色突变成浅紫色,停止滴加。接着向溶液中加入稍过量的KI溶液和几滴淀粉溶液,然后再用c mol/L的Na2S2O3溶液滴至终点。几次实验平均耗用Na2S2O3溶液VmL。(2Na2S2O3+I2=Na2S4O6+2NaI)
(1)写出向溶液中滴加酸性KMnO4溶液发生反应的离子方程式_____________________
(2)上述试验中稀释草酸亚铁溶液时除烧杯和玻璃棒外,还必需的玻璃仪器有__________
(3)x=_______________
(4)若实验中滴入KMnO4溶液过多,则所得x值___________(填偏大、偏小或无影响)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1905年德国化学家哈伯发明了合成氨的方法。他因此获得了1918年度诺贝尔化学奖。哈伯法合成氨需要在20—50 MPa的高压和500 ℃的高温下,用铁作催化剂,且氨转化率10%—15%。2005年6月27日美国化学会刊报道,美国俄勒冈大学的化学家使用了一种名为transFe(DMeOPrPE)2Cl2的铁化合物。用transFe(DMeOPrPE)2Cl2作催化剂,在常温常压下合成出氨,反应可表示为N2+3H2![]() 2NH3,有关说法正确的是
2NH3,有关说法正确的是
A. 不同的催化剂对化学反应速率影响均相同
B. 新法合成与哈伯法相比不需要在高温条件下,可节约大量能源,极具发展远景
C. 新法合成能在常温下进行是因为不需要断裂化学键
D. 哈伯法合成氨是吸热反应,新法合成氨是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com