
| A.氢气和氯气反应生成氯化氢气体的热化学方程式是H2(g)+Cl2(g)=2HCl(g) |
| B.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
| C.氢气和氯气反应生成2 mol氯化氢气体,反应的ΔH=-183 kJ·mol-1 |
| D.氢气和氯气反应生成1 mol氯化氢气体,反应的ΔH=+183 kJ·mol-1 |
科目:高中化学 来源:不详 题型:单选题
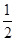 O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.84 kJ·mol-1| A.-417.91 kJ·mol-1 | B.-319.68 kJ·mol-1 |
| C.+546.69 kJ·mol-1 | D.-448.46 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
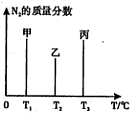
 2NH3(g) △H=—92.4kJ/mol,
2NH3(g) △H=—92.4kJ/mol,| T/K | 298 | 398 | 498 |
| 平衡常数K | 4.1×106 | K1 | K2 |
 (NH2)2CO +H2O
(NH2)2CO +H2O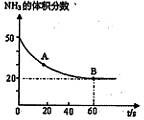
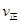 (CO2) B点的逆反应速率
(CO2) B点的逆反应速率 (CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ;
(CO2)(填写“>”“=”或“<”),NH3的平衡转化率为____ ; 2NO(g) △H =+180kJ/mol
2NO(g) △H =+180kJ/mol查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。
2012)将于2016年1月1日在我国全面实施。据此,环境空气质量指数(AQI)日报和实时报告包括了SO2、NO2、CO、O3、PM10、PM2.5等指标,为公众提供健康指引,引导当地居民合理安排出行和生活。| 方法Ⅰ | 用氨水将SO2转化(NH4)2SO3,再氧化成(NH4)2SO4 |
| 方法Ⅱ | 用生物质热解气(主要成分CO、CH4、H2)将SO2在高温下还原成单质硫 |
| 方法Ⅲ | 用Na2SO3溶液吸收SO2,再经电解转化为H2SO4 |
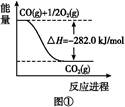
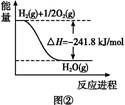

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
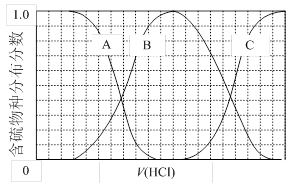
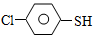 )与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。
)与甲醛、氯化氢以物质的量之比1:1:1反应,可获得一种杀虫剂中间体X和H2O。 及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为
及X的核磁共振氢谱如下图,其中 (填“Ⅰ”或“Ⅱ”)为 的核磁共振氢谱图。写出X的结构简式: 。
的核磁共振氢谱图。写出X的结构简式: 。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.△H=△H 1+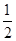 △H 2+ △H 2+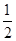 △H 3 △H 3 | B.△H=△H 1+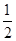 △H 2- △H 2-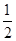 △H 3 △H 3 |
| C.△H=△H 1+2△H 2+2△H 3 | D.△H=2△H 1+△H 2+△H 3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.-74.8 kJ·mol-1 | B.+74.8 kJ·mol-1 |
| C.-211.0 kJ·mol-1 | D.+211.0 kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.反应O3+ O=2O2的ΔH=E1-E2 |
| B.反应O3+ O=2O2的ΔH=E2-E3 |
| C.反应O3+ O= 2O2是吸热反应 |
| D.反应O3+ O=2O2的ΔH=ΔH1+ΔH2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
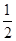 O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH1=-241.8 kJ·mol-1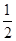 O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH2=-110.5 kJ·mol-1
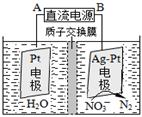
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com