
分析 (1)每生成1mol氨气,同时放出46.2kJ的热量,生成2nol氨气放热标92.4KJ,注物质聚集状态和对应反应焓变写出热化学方程式,N2和H2反应生成NH3的反应为可逆反应,反应为:N2+3H2?2NH3,可逆反应不能完全进行到底,反应物的转化率不能达到100%,此温度下的1molN2和3molH2放在一密闭容器中,不能生成2molNH3,则反应放出的热量小于92.0kJ;
(2)根据浓度的变化计算反应速率,再利用反应速率之比等于化学计量数之比来确定反应式;
解答 解:(1)每生成1mol氨气,同时放出46.2kJ的热量,生成2nol氨气放热标92.4KJ,注物质聚集状态和对应反应焓变写出热化学方程式为:N2(g)十3H2(g)?2NH3(g)△H=-92.4kJ/mol,合成氨反应是可逆反应,△H=-92.4kJ/mol是1molN2 和3molH2完全反应放出的热量.现在将1molN2 和3molH2在此条件下反应,因其为可逆反应,必然不能完全反应,放出的热量必小于92.4kJ,
故答案为:N2(g)十3H2(g)?2NH3(g)△H=-92.4kJ/mol,该反应是可逆反应,1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ;
(2)X2、Y2浓度都是1mol•L-1,达到平衡时c(X2)=0.58mol•L-1、c(Y2)=0.16mol•L-1、c(Z)=0.84mol•L-1,
则X2、Y2、Z的反应速率之比为$\frac{1mol/L-0.58mol/L}{t}$:$\frac{1mol/L-0.16mol/L}{t}$:$\frac{0.84mol/L-0}{t}$=1:2:2,
由反应速率之比等于化学计量数之比可知,该反应式为X2+2Y2?2Z,依据原子守恒得到Z的化学式为XY2;故答案为:XY2;
故答案为:XY2;
点评 本题考查了化学平衡计算应用主要是化学反应速率之比等于化学方程式系数之比,反应速率、平衡平衡状态的判断及读图表能力,难度中等,化学反应的可逆性,注意把握可逆反应的特征,应不能完全进行到底,反应物的转化率不能达到100%.


科目:高中化学 来源: 题型:选择题
 将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:
将CO2转化为 CH4,既可以减少温室气体的排放,又能得到清洁能源.已知:| A. | 0~25h内,催化剂Ⅰ的催化效果比催化剂Ⅱ的效果好 | |
| B. | 0~16h内,v(H2O)Ⅰ=1.5 mol/(L•h) | |
| C. | 在两种不同催化剂下,该反应的平衡常数不相等 | |
| D. | 反应开始后的15h内,第Ⅰ种催化剂的作用下,得到的CH4最多 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 已知氯化钴及其水合物会呈现不同颜色(如下),德国科学家发明了添加氯化钴的变色水泥,据此推测雨天变色水泥呈粉红色 | |
| B. | 有气体参加的化学反应,若增大压强(即缩小反应容器的体积),可增大活化分子的百分数,从而使反应速率增大 | |
| C. | 2CO(g)═N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 | |
| D. | 对于乙酸与乙醇的酯化反应(△H<0),加入少量浓硫酸并加热,该反应的反应速率和平衡常数均增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称量25.20g氯化钠固体 | |
| B. | 苹果含有Fe2+,现榨苹果汁在空气中会由淡绿色变为棕黄色,若榨汁时加入具有还原性的维生素C,可防止该现象发生 | |
| C. | 某固体在加入稀盐酸产生了无色无味且能使澄清石灰水变浑浊的气体,证明该固体一定含有CO32- | |
| D. | 将氢氧化钠固体在容量瓶中溶解,配制一定物质的量浓度的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
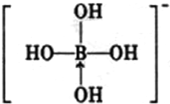 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com