
| A. | 氢氧化钡溶液与稀 H2SO4 反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O | |
| B. | 稀 H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 硝酸银溶液与铁粉反应:2Ag++Fe═Fe2++2Ag | |
| D. | 碳酸钙与盐酸反应:CO32-+2H+═H2O+CO2↑ |
分析 A.不符合离子的配比;
B.反应生成硫酸亚铁和氢气;
C.电子、电荷守恒;
D.碳酸钙在离子反应中保留化学式.
解答 解:A.氢氧化钡溶液与稀 H2SO4 反应的离子反应为Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故A错误;
B.稀 H2SO4与铁粉反应的离子反应为Fe+2H+═Fe2++H2↑,故B错误;
C.硝酸银溶液与铁粉反应的离子反应为2Ag++Fe═Fe2++2Ag,故C正确;
D.碳酸钙与盐酸反应的离子反应为CaCO3+2H+═Ca2++H2O+CO2↑,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重复分解反应、氧化还原反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:多选题
| A. | 石油的裂解可以提高汽油等轻质油的质量和产量 | |
| B. | 在一定条件下煤和氢气作用得到液体燃料的过程是煤的液化途径之一 | |
| C. | 葡萄糖、淀粉、油脂在一定条件下都能发生水解反应 | |
| D. | 往蛋白质溶液中加入饱和硫酸铵溶液,产生的沉淀再加水又可溶解 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
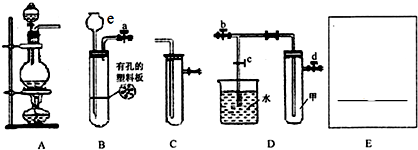
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数的大小与温度、浓度、压强、催化剂等有关 | |
| B. | Ksp(AgCl)>Ksp(AgI),由此可以判断AgCl(s)+I-(aq)?AgI(s)+Cl-(aq)能够发生 | |
| C. | 当温度升高时,弱酸的电离平衡常数Ka变小 | |
| D. | 化学平衡常数不变时,说明化学反应已达化学平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25℃由水电离的c(H+)=10-12mol/L 的溶液:Fe3+ Cl- NO3- K+ | |
| B. | 使酚酞变红的溶液:Na+ Cl- SO42-AlO2- | |
| C. | 某无色溶液:HCO3- NO3- Al3+ Ba2+ | |
| D. | 25℃时,pH=1的溶液:Ba2+ NO3- K+ I- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入稀盐酸产生无色气体,该气体能使澄清石灰水变浑浊,则原溶液中一定有CO32- | |
| B. | 鉴别碳酸钠溶液和碳酸氢钠溶液,可以用稀CaCl2 溶液 | |
| C. | 做焰色反应时,每次实验要将铂丝用水洗干净,再蘸取其他物质在灯焰上灼烧 | |
| D. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,则原溶液中一定有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验组 | 温度/K | 平衡浓度mol/L | ||
| CH3OH | CH3OCH3 | H2O | ||
| l | 403 | 0.01 | 0.2 | 0.2 |
| 2 | 453 | 0.02 | 0.3 | 0.4 |
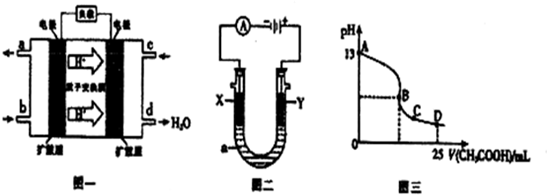
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol乙酸在浓H2SO4存在下与足量乙醇反应可得1 mol乙酸乙酯 | |
| B. | 对苯二甲酸(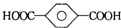 ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 ( ) 与乙二醇(HOCH2CH2OH)能通过加聚反应制取聚酯纤维 (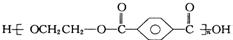 ) ) | |
| C. | 分子式为C5H12O的醇,能在铜催化下被O2氧化为醛的同分异构体有4种 | |
| D. |  分子中的所有原子有可能共平面 分子中的所有原子有可能共平面 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com