
| A. | CH2=CH2+HCl $→_{△}^{催化剂}$ CH3CH2Cl | |
| B. | CH4+Cl2 $\stackrel{光}{→}$CH3Cl+HCl | |
| C. | nCH2=CH2$→_{加热、加压}^{催化剂}$ | |
| D. | CH3CH2Br+NaOH$→_{△}^{乙醇}$CH2=CH2↑+NaBr+H2O |
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 砹是有色固体 | B. | 砹易溶于有机溶剂 | ||
| C. | H2很难与砹化合 | D. | HAt比HCl稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 (1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.
(1)为了做到合理营养,我国营养学家将食物分为A、B、C、D、E五类,请回答下列问题:①营养学家将这五类形象地设计成图示的“平衡膳食宝塔”,并提倡居民每天均衡地吃这五类食物.为保证身体健康,建议在每日摄入的总能量中,早、中、晚餐的能量比例是3:4:3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
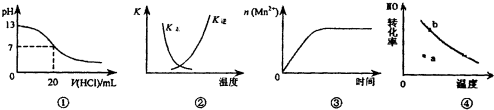
| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0,1 mol•L-1 NaOH溶液,溶液的pH随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g):△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④曲线表示2NO+O2?2NO2中NO的最大转化率与温度的关系,a点表示未达到平衡状态,且v(正)<v(逆) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:
A、B、C、X是中学化学常见物质,均由短周期元素组成,转化关系如图所示.请针对以下不同情况回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁离子的电子式Mg2+ | B. | Cl的结构示意图 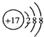 | ||
| C. | 氯离子的电子式Cl- | D. | 质量数为37的氯原子${\;}_{37}^{17}$Cl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
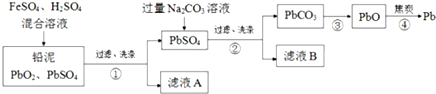
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com