
| A. | 当x=n时,反应的离子方程式为:2Fe2++Cl2=2Fe3++2Cl- | |
| B. | 当x=2n,反应的离子方程式为:2Fe2++2I-+2Cl2=2Fe3++I2+4Cl- | |
| C. | 当x>n时,Fe2+和I-均被氧化 | |
| D. | 氧化性顺序:Cl2>I2>Fe3+ |
分析 已知还原性Г>Fe2+,在含有n mol Fel2的溶液中通入Cl2,先发生反应Cl2+2I-=I2+2Cl-,继续通入氯气发生反应Cl2+2Fe2+=2Fe3++2Cl-,依据反应的定量关系分析计算;
解答 解:A.已知还原性Г>Fe2+,在含有n mol Fel2的溶液中,n(I-)=2nmol,n(Fe2+)=nmol,通入Cl2,有x mol Cl2发生反应,当x=n时,反应的离子方程式为:
Cl2+2I-=I2+2Cl-,
1 2
n 2n
恰好和碘离子发生,反应的离子方程式为 Cl2+2I-=I2+2Cl-,故A错误;
B.当x=2n,Cl2+2I-=I2+2Cl-,碘离子消耗氯气nmol,剩余nmol氯气发生反应Cl2+2Fe2+=2Fe3++2Cl-,nmolFe2+离子需要0.5molCl2氧化,剩余0.5molCl2,反应的离子方程式为:2Fe2++4I-+3Cl2=2Fe3++2I2+6Cl-,故B错误;
C.当x=n时,反应的离子方程式为:
Cl2+2I-=I2+2Cl-,
1 2
n 2n
恰好和碘离子发生,当x>n时,Fe2+和I-均被氧化,故C正确;
D.氧化剂的氧化性大于氧化产物,Cl2+2I-=I2+2Cl-,Cl2+2Fe2+=2Fe3++2Cl-,已知还原性Г>Fe2+,2Fe3++2I-=I2+2Fe2+,氧化性顺序为Cl2>Fe3+>I2 ,故D错误;
故选C.
点评 本题考查氧化还原反应顺序分析,氧化剂的氧化性大于氧化产物,还原剂的还原性大于还原产物,顺序反应的定量计算是解题关键,题目难度中等.


 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 为使反应充分进行,应将盐酸分次加入碱液中 | |
| B. | 为使反应刚好完全进行,应使用浓度和体积相同的NaOH和HCl溶液 | |
| C. | 测量初始温度时,测量盐酸后需清洗温度计再测量NaOH溶液温度 | |
| D. | 如无玻璃环形搅拌棒,可利用铁丝或铜丝代替 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | 分子式为C2H4,能使酸性商锰酸钾溶液褪色 |
| B | 相对分子质量为78,是最简单的芳香族化合物 |
| C | 分子式为C2H6O,能与金属钠反应生成氢气 |
| D | 含C-O键,-个D分子比一个C分子少两个氢原子 |
| E | 是食醋的有效成分,可与C物质发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
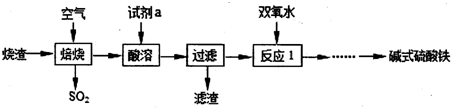
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于放热反应 | B. | 属于氧化还原反应 | ||
| C. | 属于复分解反应 | D. | 属于离子反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com