
����Ŀ��ij�������ﺬNH4I��NaHCO3��AlCl3��MgBr2��FeCl2�еļ���,Ϊȷ���ù�������ijɷּ�����ɳɷֵ����ʵ���֮��,�ֽ�������ʵ�顣
ʵ����:

(1)��ɫ����Ϊ_______��
(2)�ù�������ijɷ�Ϊ_______��
ʵ����:ȡһ�����ĸù�����������ˮ���1 L��Һ,����û����Һ��ͨ��һ������Cl2,�����Һ�м���������(�ֱ���A-��B-��C-��ʾ)�����ʵ�����ͨ��Cl2����Ĺ�ϵ�����ʾ��

(3)a=____��
(4)ԭ���������и���ɳɷֵ����ʵ���֮��Ϊ_________��
���𰸡�NH3 NH4I��MgBr2��AlCl3 0.15 n(AlCl3)��n(MgBr2)��n(NH4I)=20��45��24
��������
(1)�������NaOHŨ��Һ�����ȣ����ɵ���ɫ����ֻ����NH3��˵��һ������NH4I�����Ա���𰸣� NH3��
(2)�������NaOHŨ��Һ�����ɵİ�ɫ���������ޱ仯��˵��һ����FeCl2��һ����MgBr2��������ɫ��Һ������ϡ��������ɫ�������ӹ���ϡ�����������ܽ⣬�����ݲ������Ƴ���AlCl3��NaHCO3�����Ա���𰸣� NH4I��MgBr2��AlCl3��
(3) ��Һ�������ӻ�ԭ��ǿ��˳��ΪI->Br->Cl-�������2.8L���������ʵ���Ϊ2.8L��22.4Lmol-1=0.125mol��ͨ��0.125mol ����ʱ��Һ����I-������Br-û�вμӷ�Ӧ������Һ��n(Br-)=1.5mol,����n(B)Ϊ�����ӣ���Һ��������Ϊͨ���������ɵĺ�ԭ����Һ�д��ڵģ�����A-����ΪCl-,C-����ΪI-���ӣ�Clԭ���غ��ԭ��n(Cl-)=1.25mol-0.125mol��2=1mol��ͨ��5.6L�������ʵ���=5.6L��22.4L/mol=0.25mol����ʱ��Һ��û��I-�����������ȫ��Ӧ����n(Br-)=1.4mol��˵����0.1mol�����Ӳμӷ�Ӧ�����������ȫ��Ӧ������ת�Ƶ�����ȵ�n(I-)=0.25mol��2-0.1mol��1=0.4mol,���ݷ�Ӧ:Cl2+2I-�TI2+2Cl-���÷�Ӧ������0.25mol ���������ĵ�����,����a=0.4mol-0.25mol=0.15mol������𰸣�0.15��
(4)������֪��ԭ�����Һ��n(Cl-)=1.25 mol-0.125 mol��2=1 mol��n(Br-)=1.5 mol��n(I-)=0.15 mol+0.125 mol��2=0.4 mol����n(AlCl3)��n(MgBr2)��n(NH4I)=[n(Cl-)/3]��[n(Br-)/2]��n(I-)=1/3mol��1.5/2mol��0.4 mol=20��45��24��
���Ա���𰸣�n(AlCl3)��n(MgBr2)��n(NH4I)=20��45��24��


 ȫ�ܲ��һ���þ�ϵ�д�
ȫ�ܲ��һ���þ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������к��зḻ�ĵ�Ԫ��(��I-��ʽ����)��ʵ��������ȡ���������ͼ��
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() �D��
�D��![]()
��1��ʵ������۵�������__��������Ҫ��������Ϊ__��
��2����ȡ��Ĺ����У��ɹ�ѡ����л��Լ���___(����)��ѡ���������___��
A.�ƾ�(�е�78��) B.���Ȼ�̼(�е�77��)
C.����(�е�290��) D.��(�е�80��)
��3���ӵ���л���Һ�еõ����ʵ�ķ�����___��
��4����������պ���ʱ������Ҫ���ż��⣬����Ҫ�õ���ʵ��������__(������������ѡ�����������������ĸ��д�ڿհ״�)��
A.�ձ� B.���� C.������ D.������ E.�ƾ��� F.������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ��ijͬѧ���һ��ȼ�ϵ�ز�̽���ȼҵԭ���ʹ�ͭ�ľ���ԭ����������װ����XΪ�����ӽ���Ĥ��

����Ҫ��ش�������⣺
��1��ͨ�������ĵ缫Ϊ___�������������������������������ĵ缫��ӦʽΪ__��
��2��ʯī�缫(C)�缫Ϊ___��������������������������Fe�缫�ĵ缫��ӦʽΪ__��
��3����Ӧһ��ʱ�����װ������������������Ҫ��__��������������������ʯī������
��4�������ͭ�к���п���������ʣ����װ���з�Ӧһ��ʱ�������ͭ��ҺŨ�Ƚ�__����������������С����������������
��5�����ڱ�״���£���4.48L�����μӷ�Ӧ������װ�������缫�����ɵ�����ķ�����Ϊ__����װ������������ͭ������Ϊ__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з��ӻ������У�VSEPRģ����������ӻ����ӵ����幹�����Ʋ�һ�µ���
A. CO2 B. H2O C. CO32�� D. CCl4
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶�ʱ����2 L������A��B�������ʼ��ת����Ӧ�У�A��B���ʵ�����ʱ��仯��������ͼ��ʾ����ͼ�����ݷ����ã�

��1���÷�Ӧ�Ļ�ѧ����ʽΪ___________________��
��2����Ӧ��ʼ��4 minʱ��A��ƽ����Ӧ����Ϊ____________________________��
��3��4 minʱ����Ӧ�Ƿ�ﵽƽ��״̬��________(����������������)��8 minʱ��v(��)________v(��) (������������������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ҵ����ij�����̿�(��Ҫ�ɷ�MnO2������Fe2O3��Fe2O3��SiO2��)���������ͬ���Ƶ�KMnO4�������£�
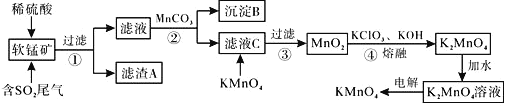
��֪��Ksp[Fe(OH)3]=4��10-38��Ksp[Al(OH)3]=1��10-33���ش��������⣺
(1)����A�ijɷ���______�����еĻ�ѧ����������______���ȶ��ԣ�SiH4 ______H2S (����>������<��)��
(2)��������Bʱ������������������______���Լ�����η���![]() �еij�����______��
�еij�����______��
(3)��ҺC�м���KMnO4ʱ������Ӧ�����ӷ���ʽ��__________��
(4)�������̵ĵڢܡ��ݡ�������ͼ��ʾ�����еڢ�����Ƭ������(�������뷴Ӧ)������Ϊ���������![]() ��Һ���Ʊ�
��Һ���Ʊ�![]() ��
��
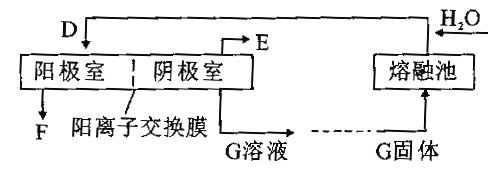
��д�����ڳ��еĻ�ѧ����ʽ___________��
����E�Ļ�ѧʽΪ_________�������ĵ缫��ӦʽΪ__________��
��������Ǩ�Ʒ�����__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ӦA(g)��3B(g) ![]() 2C(g)��2D(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ
2C(g)��2D(g)�����ֲ�ͬ����µķ�Ӧ���ʷֱ�Ϊ
��v(A)��0.45 mol��L��1��min��1 ��v(B)��0.6 mol��L��1��s��1 ��v(C)��0.4 mol��L��1��s��1 ��v(D)��0.45 mol��L��1��s��1���÷�Ӧ���еĿ���˳��Ϊ
A. ��>�ۣ���>�� B. ��<�ۣ���<�� C. ��>��>��>�� D. ��>��>��>��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������dz��õ��л��ܼ��������л���A������ʽ��C4H8O��ͨ������·���Ƶ�

��֪��R1X + R2OH![]() R1OR2 + HX
R1OR2 + HX
����˵������ȷ����
A. C�к��еĹ����Ž�Ϊ�Ѽ� B. A�Ľṹ��ʽ��CH3CH=CHCH2OH
C. D��E����ʹ���Ը��������Һ��ɫ D. �٢۵ķ�Ӧ���ͷֱ�Ϊ�ӳɷ�Ӧ����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����( )
A. ������ڽ����Ȼ����Ʊ�Na��Mg��Al
B. ����![]() ��Һʱ�����ϡ�����ֹˮ��
��Һʱ�����ϡ�����ֹˮ��
C. ��һ��һ·���е�˿�����Ҫ�ɷ�����Ȼ��ά�أ����ڸ߷��ӻ����
D. ���ݵĿ�����Ca5(PO4)3OH+F-![]() Ca5(PO4)3F+OH-����ʹ�ú���������Է�ֹȣ�ݵ��γ�
Ca5(PO4)3F+OH-����ʹ�ú���������Է�ֹȣ�ݵ��γ�
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com