
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 L 0.1 mol·L-1的氨水中含有NH3·H2O分子数为0.1NA
B.电解精炼铜时,若阳极质量减少6.4 g,则电路中转移电子数为0.2NA
C.标准状况下,2.24 L的二氯甲烷中含有的碳氯共价键的数目为0.2NA
D.一定条件下,4.6 g NO2和N2O4混合气体中含有的N原子数目为0.1NA
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2014高考名师推荐化学电解三池的应用(解析版) 题型:选择题
如下图所示,其中甲池的总反应式为2CH3OH+3O2+4KOH=2K2CO3+6H2O,下列说法正确的是

A.甲池是电能转化为化学能的装置,乙、丙池是化学能转化电能的装置
B.甲池通入CH3OH的电极反应式为CH3OH-6e-+2H2O=CO32-+8H+
C.反应一段时间后,向乙池中加入一定量Cu(OH)2固体能使CuSO4溶液恢复原浓度
D.甲池中消耗280 mL(标准状况下)O2,此时丙池中理论上最多产生1.45 g固体
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
ⅤA族的氮、磷、砷(As)、锑(Sb)等元素在化合物中常表现出多种氧化态,含ⅤA族元素的化合物在科研和生产中有许多重要用途。请回答下列问题:
(1)N、P、As原子的第一电离能由大到小的顺序为 (用元素符号表示)。
(2)As原子核外M层电子的排布式为 。
(3)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N互为等电子体的分子的化学式 (任写一种即可)。

图1
(4)白磷(P4)的结构如图1所示,P原子的轨道杂化方式是 。
(5) 可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
可以与许多金属离子形成配合物,例如[ Co(NO2)6]3-,它可以用来检验K+,其反应如下:3K++[Co(NO2)6]3-=K3[Co(NO2)6]↓(亮黄色)。
① 的立体构型是 。
的立体构型是 。
②在K3[Co(NO2)6]中,中心离子的配位数为 。
(6)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸(HOCH2CHCOOHNH2)。判断丝氨酸是否存在手性异构体? (填“是”或“否”)。

图2
(7)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图2所示,其晶胞边长为cpm,则密度为 g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为 pm(用含c的式子表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质结构与性质推断(解析版) 题型:填空题
在电解炼铝过程中加入冰晶石(用“A”代替),可起到降低Al2O3熔点的作用。冰晶石的生产原理为2Al(OH)3+12HF+3Na2CO3=2Al+3CO2↑+9H2O。根据题意完成下列填空:
(1)冰晶石的化学式为 ,含有离子键、 等化学键。
(2)生成物中含有10个电子的分子是 (写分子式),该分子的空间构型为 ,中心原子的杂化方式为 。
(3)反应物中电负性最大的元素为 (填元素符号),写出其原子最外层的电子排布图: 。
(4)Al单质的晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。
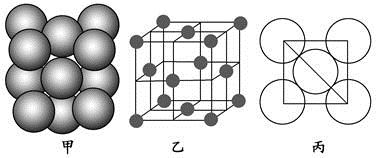
若已知Al的原子半径为d,NA代表阿伏加德罗常数,Al的相对原子质量为M,则一个晶胞中Al原子的数目为 ;Al晶体的密度为 (用字母表示)。
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的量及相关计算(解析版) 题型:选择题
用固体样品配制一定物质的量浓度的溶液,需经过称量、溶解、转移溶液、定容等操作。下列图示对应的操作规范的是

A.称量 B.溶解 C.转移 D.定容
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的组成、性质及分类(解析版) 题型:选择题
下列说法在一定条件下可以实现的是
①酸性氧化物与碱发生反应 ②弱酸与盐溶液反应可以生成强酸 ③没有水生成,也没有沉淀和气体生成的复分解反应 ④两种酸溶液充分反应后的溶液体系为中性 ⑤有单质参加的非氧化还原反应 ⑥两种氧化物反应的产物有气体
A.①②③④⑤⑥ B.②④⑤⑥ C.①②③⑤ D.③④⑤⑥
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学物质的分离和提纯(解析版) 题型:选择题
下列有关分离和提纯的说法正确的是
A.用浓溴水除去苯中混有的苯酚
B.用蒸馏的方法从海水中得到淡水
C.用分液的方法分离乙酸和乙酸乙酯
D.用浓硫酸除去氨气中混有的水蒸气
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学水的电离与溶液酸碱性(解析版) 题型:选择题
下列溶液中微粒浓度关系一定正确的是
A 均为0.10mol·L-1 NH4Cl和NH4HSO4溶液,c(NH4+)前者小于后者
B 25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
C 25℃时pH=11的NaOH和pH=11的氨水分别稀释100倍后的pH前者一定大于后者
D. 25℃时,pH=4的盐酸与pH=10的氨水溶液等体积混合后pH< 7
查看答案和解析>>
科目:高中化学 来源:2014高考名师推荐化学盐类水解的概念与离子浓度大小比较(解析版) 题型:选择题
氯碱工业中电解饱和食盐水的原理示意图如下图所示:

(1)溶液A的溶质是 ;
(2)电解饱和食盐水的离子方程式是 ;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用 ;
(4)电解所用的盐水需精制。去除有影响的Ca2+、Mg2+、NH4+、SO42-[c(SO42->c(Ca2+)]。精制流程如下(淡盐水和溶液A来自电解池):
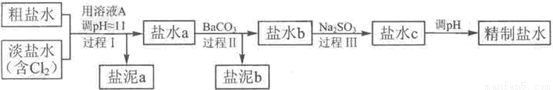
①盐泥a除泥沙外,还含有的物质是 。
②过程Ⅰ中将NH4+转化为N2的离子方程式是 ;
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com