


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
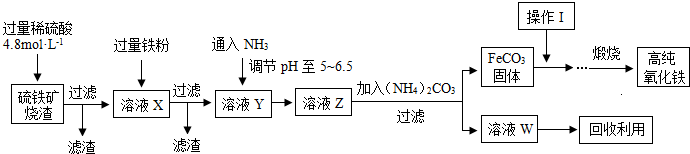
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:问答题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 选项 | A | B | C | D |
| 试剂 | 氯水 | 氢氧化钠溶液 | 铁屑 | KSCN溶液 |
| 现象 | 出现黄褐色 | 最终生成红褐色沉淀 | 绿色 | 有较浅的血红色 |
| A.A | B.B | C.C | D.D |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.①②③ | B.①③④ | C.①② | D.②③ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL蒸馏水 | 4 mL 蒸馏水 +3滴浓H2SO4 | 4 mL 蒸馏水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
| 试管编号 | 1 | 2 | 3 |
| 加入的药品和数量 | 4 mL饱和食盐水 | 4 mL饱和食盐水 +3滴浓H2SO4 | 4 mL饱和食盐水 +3滴NaOH浓溶液 |
| 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴甲基橙试剂 2 mL乙酸乙酯 | 3滴石蕊溶液 2 mL乙酸乙酯 |
查看答案和解析>>
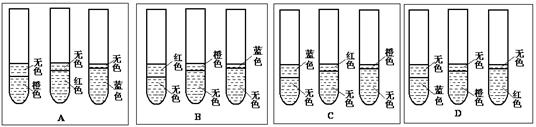
科目:高中化学 来源:不详 题型:实验题
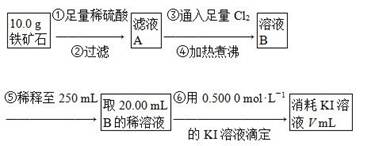
查看答案和解析>>
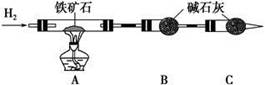
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com