
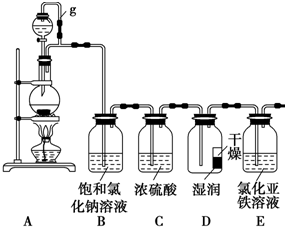
 ij̽��С��Ϊ̽�����������ʣ����������ʵ��װ�ã���ش��������⣺
ij̽��С��Ϊ̽�����������ʣ����������ʵ��װ�ã���ش��������⣺���� ��1���ٷ�Ӧ�д����������Ԫ�ػ��ϼ۱仯Ϊ��+1��0����Ӧ�����Ȼ��⻯�ϼ۱仯Ϊ��-1��0������������ԭ��Ӧ��ʧ�����غ㣬1molCa��ClO��2��Ӧ�õ�2mol���ӣ����������Ȼ�������ʵ���Ϊ2mol�������������ʵ���Ϊ2mol������ԭ�Ӹ����غ���ƽ����ʽ��
�ڵ����ܽ���Һ©����Բ����ƿ������ʹ�����ڲ�ѹǿ��ȣ�
��2����������ʹ��ɫ������ɫ��HClOʹ��ɫ��������ɫ��ˮ���ӵ��˶���������
��3����������ǿ�������ԣ��ܹ������Ȼ����������Ȼ�����
��4�������ܹ�������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ������������������Һ����������
��� �⣺��1���ٷ�Ӧ�д����������Ԫ�ػ��ϼ۱仯Ϊ��+1��0����Ӧ�����Ȼ��⻯�ϼ۱仯Ϊ��-1��0������������ԭ��Ӧ��ʧ�����غ㣬1molCa��ClO��2��Ӧ�õ�2mol���ӣ����������Ȼ�������ʵ���Ϊ2mol�������������ʵ���Ϊ2mol������ԭ�Ӹ����غ㷴Ӧ����ʽ��Ca��ClO��2+4HCl=2Cl2��+CaCl2+2H2O��
�ʴ�Ϊ��1��4HCl��2��1��2H2O��
�ڵ����ܽ���Һ©����Բ����ƿ������ʹ�����ڲ�ѹǿ��ȣ�ʹŨ������˳���ص�����ƿ�У�
�ʴ�Ϊ��ƽ��ѹǿ��ʹŨ������˳���ص�����ƿ�У�
��2��ʵ�������������ʪ��ֽ���е�ˮ����HClO��ʹֽ��ʪ����ɫ������IJ�����ˮ����������HClO���Բ���ɫ������һ��ʱ�������ˮ�����˶�������ֽ�������ʪ�����Ծ�ȫ����ɫ�ˣ�
�ʴ�Ϊ���������� ʵ�������������ʪ��ֽ���е�ˮ����HClO��ʹֽ��ʪ����ɫ������IJ�����ˮ����������HClO���Բ���ɫ������һ��ʱ�������ˮ�����˶�������ֽ�������ʪ�����Ծ�ȫ����ɫ�ˣ�
��3���������Ȼ�������Ӧ�����Ȼ�������ѧ����ʽ��2Fe Cl2+Cl2�T2FeCl3��
�ʴ�Ϊ��2FeCl2+Cl2�T2FeCl3��
��4�������ܹ�������������Һ��Ӧ�����Ȼ��ơ��������ƺ�ˮ������������������Һ������������ѧ����ʽ��Cl2+2NaOH=NaCl+NaClO+H2O��
�ʴ�Ϊ��Cl2+2NaOH=NaCl+NaClO+H2O��
���� ���⿼����������ȡʵ��װ�ü����������ʣ���ȷװ�õ����ü�װ���з����Ļ�ѧ��Ӧ���ɽ���ѶȲ���


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ�ͭ��Һ��п�۷�Ӧ��Cu2++Zn�TZn2++Cu | |
| B�� | ϡ H2SO4�����۷�Ӧ��2Fe2++6H+�TFe3++3H2�� | |
| C�� | ����������Һ��CuSO4 ��Һ��Ӧ��Ba2++SO42-�TBaSO4�� | |
| D�� | ̼��������ᷴӦ��CO32-+2H+�TH2O+CO2�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 0.8g | B�� | 1.6mg | C�� | ��2m-3.2g�� | D�� | ��2m-1.6��g |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ʵ������50mL 0.50 mol•L-1���ᡢ50mL 0.55mol•L-1 NaOH��Һ����ͼ��ʾװ�ã����вⶨ�к��ȵ�ʵ�飬�õ����е����ݣ�
ʵ������50mL 0.50 mol•L-1���ᡢ50mL 0.55mol•L-1 NaOH��Һ����ͼ��ʾװ�ã����вⶨ�к��ȵ�ʵ�飬�õ����е����ݣ�| ʵ����� | ��ʼ�¶�t1/�� | ��ֹ�¶�t2/�� | |
| ���� | NaOH��Һ | ||
| 1 | 20.2 | 20.3 | 23.7 |
| 2 2 | 20.3 | 20.5 | 23.8 |
| 3 | 21.5 | 21.6 | 24.9 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Ŀǰ�ӵ�ʳ����Ҫ���ӵ���KIO3 | |
| B�� | ��±�������ƶ��� | |
| C�� | ����������ˮ��ɱ�������� | |
| D�� | �ڿ��������ձ���SO2�������ڿ�����Ⱦָ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com